题目内容
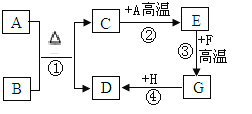
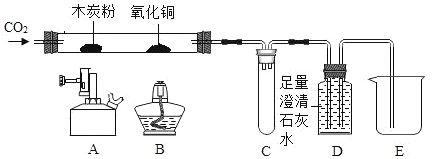
【题目】某同学用如下装置,进行有关碳及其氧化物的实验(图中固定试管的仪器已略去)。
步骤 | 现象 | 分析 |
(1)点燃A处酒精喷灯一段时间 | A处黑色粉末减少 | A处相应的化学方程式为_____ |
D中_____ | D装置作用是_____ | |
(2)再点燃B处酒精灯一段时间 | B处_____ | B处相应的化学方程式为_____ |
(3)停止通入CO2,熄灭A、B两处火焰 | D中液体倒流入C中 | C装置的作用为_____ |
【答案】CO2+C![]() 2CO 澄清石灰水变浑浊,液面下降 储存 CO,防止其逸出污染环境 黑色固体逐渐变红 CuO+CO
2CO 澄清石灰水变浑浊,液面下降 储存 CO,防止其逸出污染环境 黑色固体逐渐变红 CuO+CO![]() Cu+CO2 防止液体倒流入玻璃管中,造成玻璃管炸裂
Cu+CO2 防止液体倒流入玻璃管中,造成玻璃管炸裂
【解析】
(1)木炭粉是黑色粉末,二氧化碳与碳在高温条件下反应生成一氧化碳。二氧化碳能使澄清石灰水变浑浊,二氧化碳进入装置D中,由于压强变大,将液体排出,所以实验现象是澄清石灰水变浑浊,液面下降。尾气中含有一氧化碳,D装置作用是储存 CO,防止其逸出污染环境。
(2)生成的一氧化碳能将氧化铜还原为铜,B处的实验现象是黑色固体逐渐变红。一氧化碳与氧化铜反应生成铜和二氧化碳。
(3)停止通入CO2,熄灭A、B两处火焰,A、B处温度降低,压强变小,如果没有装置C,D中液体会倒流入A、B中,所以装置C的作用是防止液体倒流入玻璃管中,造成玻璃管炸裂。

 名校课堂系列答案
名校课堂系列答案【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。