题目内容
【题目】根据下列装置图回答下列问题:

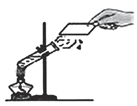
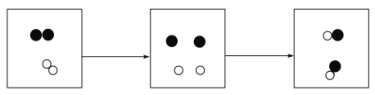
(1)装置图(甲)是根据白磷在燃烧前后天平的状态来探究质量守恒定律。在实验中引燃锥形瓶中的白磷(化学式为P)。锥形瓶中的现象为___________,发生的化学方程式为____________,锥形瓶上气球的作用是_________,气球在反应中和反应后的变化是________。
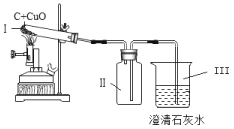
(2)装置图(乙)试管中固体混合物颜色变化为___________,澄清石灰水变浑浊发生的反应的化学方程式为_______________。
【答案】发出黄光,产生大量的白烟 4P+5O2![]() 2P2O5 起缓冲作用,防止气体受热膨胀冲开胶塞, 先变大,逐渐变小,最后变为比燃烧前更小 黑色逐渐变为红色 Ca(OH)2+CO2=CaCO3↓+H2O
2P2O5 起缓冲作用,防止气体受热膨胀冲开胶塞, 先变大,逐渐变小,最后变为比燃烧前更小 黑色逐渐变为红色 Ca(OH)2+CO2=CaCO3↓+H2O
【解析】
(1)白磷燃烧发出黄光,产生大量白烟,故填发出黄光,产生大量白烟;白磷燃烧是白磷和氧气反应生成五氧化二磷,方程式故填4P+5O2![]() 2P2O5 ;锥形瓶上气球的作用是起缓冲作用,防止气体受热膨胀冲开胶塞,故填起缓冲作用,防止气体受热膨胀冲开胶塞;反应放出热量使锥形瓶内气体体积膨胀,气球变大,反应后温度降低气体体积缩小,气球变小,冷却到室温后,由于氧气被消耗,气球比燃烧前更瘪,故填先变大,逐渐变小,最后变为比燃烧前更小;
2P2O5 ;锥形瓶上气球的作用是起缓冲作用,防止气体受热膨胀冲开胶塞,故填起缓冲作用,防止气体受热膨胀冲开胶塞;反应放出热量使锥形瓶内气体体积膨胀,气球变大,反应后温度降低气体体积缩小,气球变小,冷却到室温后,由于氧气被消耗,气球比燃烧前更瘪,故填先变大,逐渐变小,最后变为比燃烧前更小;
(2)氧化铜和木炭粉都是黑色固体,木炭还原氧化铜生成同和二氧化碳,装置图(乙)试管中固体混合物颜色变化故填黑色逐渐变为红色;二氧化碳能使澄清石灰水变浑浊是由于反应生成了难溶于水的碳酸钙,还生成了水,方程式故填Ca(OH)2+CO2=CaCO3↓+H2O。

 习题精选系列答案
习题精选系列答案【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
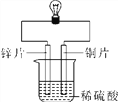
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。
(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能
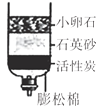
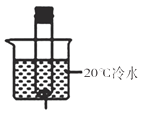
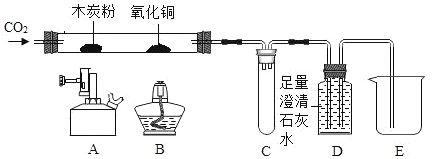
【题目】某同学用如下装置,进行有关碳及其氧化物的实验(图中固定试管的仪器已略去)。
步骤 | 现象 | 分析 |
(1)点燃A处酒精喷灯一段时间 | A处黑色粉末减少 | A处相应的化学方程式为_____ |
D中_____ | D装置作用是_____ | |
(2)再点燃B处酒精灯一段时间 | B处_____ | B处相应的化学方程式为_____ |
(3)停止通入CO2,熄灭A、B两处火焰 | D中液体倒流入C中 | C装置的作用为_____ |