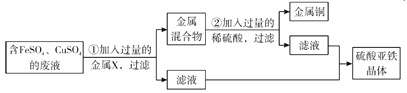
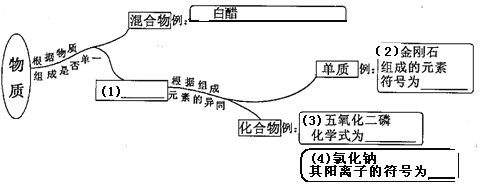
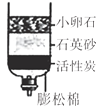
题目内容
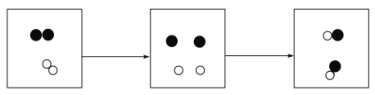
【题目】某物质可能由![]() C中的一种或几种组成,今测得该物质中氧的质量分数为30%,如该物质为纯净物,则该物质为_________;若该物质为混合物,则该物质中一定含有的物质是__________,写出该混合物组成最少的一种可能_______(均填写化学式)。
C中的一种或几种组成,今测得该物质中氧的质量分数为30%,如该物质为纯净物,则该物质为_________;若该物质为混合物,则该物质中一定含有的物质是__________,写出该混合物组成最少的一种可能_______(均填写化学式)。
【答案】Fe2O3 KCl Al2O3、KCl(或MgO、KCl)
【解析】
氧化铝中氧元素的质量分数为:![]() =47.1%,氧化镁中氧元素的质量分数为:
=47.1%,氧化镁中氧元素的质量分数为:![]() =60%,Fe2O3中氧元素的质量分数为:
=60%,Fe2O3中氧元素的质量分数为:![]() =30%,氯化钾中不含有氧元素,故填Fe2O3。由上分析可知,氧化铝、氧化镁中氧元素的质量分数都大于30%,要使混合物中氧元素的质量分数等于30%,则应当要有不含有氧元素的KCl。氧化镁和氧化铝中氧元素的质量分数大于30%,只要有一种含氧元素小于30%的物质即可混合得到含氧30%的混合物,故组合为Al2O3、KCl(或MgO、KCl)。
=30%,氯化钾中不含有氧元素,故填Fe2O3。由上分析可知,氧化铝、氧化镁中氧元素的质量分数都大于30%,要使混合物中氧元素的质量分数等于30%,则应当要有不含有氧元素的KCl。氧化镁和氧化铝中氧元素的质量分数大于30%,只要有一种含氧元素小于30%的物质即可混合得到含氧30%的混合物,故组合为Al2O3、KCl(或MgO、KCl)。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】某化学兴趣小组对粉笔中碳酸钙含量进行了探究。小组成员从一包粉笔产品中取出样品5.10g放入烧杯中,并逐滴加入相同浓度的稀盐酸(假设样品中的杂质不参与反应),实验测得产生气体的质量与加入稀盐酸的总质量关系如下表所示。
稀盐酸的总质量(g) | 10.00 | 20.00 | 30.00 | 40.00 | 50.00 | 60.00 |
产生气体的质量(g) | 0.44 | 0.88 | m | 1.76 | 2.20 | 2.20 |
求:(1)、表中m =________;
(2)、样品中碳酸钙的质量分数_______ (写出计算过程,要求结果保留一位小数)。
【题目】实验室部分装置如下图所示,请回答:
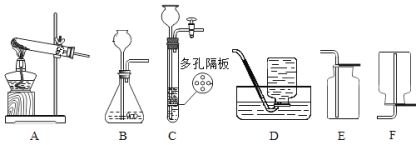
(提示:装置C的多孔隔板,可以放置颗粒大小比孔径大的固体)
(1)下表是初中几种常见气体的实验室制法,请你在横线上的空白处填上答案。
反应物 | 制取气体 | 发生装置(填字母) | 收集装置(填字母) |
大理石和稀盐酸 | CO2 | B或____ | _______ |
锌粒和稀硫酸 | H2 | B | D或____ |
高锰酸钾 | _______ | A | E或____ |
(2)大理石和稀盐酸反应制二氧化碳的化学方程式为:___________。
(3)若使用图1装置收集氧气,气体应从_____________(填“a”或“b”)端通入。若通过连接图1和图2装置来测量氧气的体积,应将图2装置的c端与图1装置的_____________(填“a”或“b”)端相连。
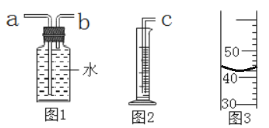
一段时间后量筒内的凹液面如图3所示,则集得氧气的体积是_______mL。
【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。
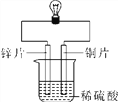
(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能
【题目】某同学用如下装置,进行有关碳及其氧化物的实验(图中固定试管的仪器已略去)。
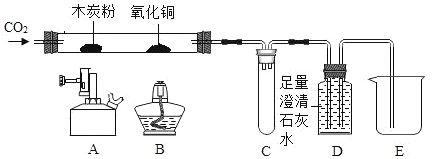
步骤 | 现象 | 分析 |
(1)点燃A处酒精喷灯一段时间 | A处黑色粉末减少 | A处相应的化学方程式为_____ |
D中_____ | D装置作用是_____ | |
(2)再点燃B处酒精灯一段时间 | B处_____ | B处相应的化学方程式为_____ |
(3)停止通入CO2,熄灭A、B两处火焰 | D中液体倒流入C中 | C装置的作用为_____ |