题目内容
【题目】下图是某食盐包装上的部分说明。食盐中加入碘酸钾的目的是补充微量元素___________。

【提出问题】为什么在汤、菜即将煮好时再加入碘盐才能确保碘效?
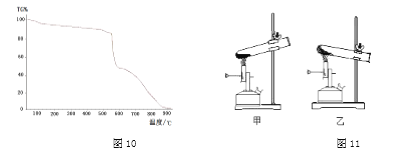
【查阅资料】碘酸钾的化学式是KIO3,是一种白色粉末,熔点560℃。采用热重分析仪对碘酸钾加热过程展开研究,混合物中碘酸钾的的质量分数(纵坐标)随温度(横坐标)变化的曲线如图10所示。
【猜想假设1】KIO3与KClO3性质类似,受热分解产生O2。
【实验探究1】研究小组进行如图11所示实验,宜选用装置___________进行。验证KIO3分解产生氧气的操作和现象为_________________________。
【得出结论1】KIO3受热同时生成碘化钾(KI),反应方程式为_____________________。
【提出新问题】为什么生成KI就会降低碘效?
【查阅资料2】KIO3在人体内转化为I-而被吸收。KI是白色固体,在空气中与O2、CO2、H2O中的两种或三种物质反应生成单质I2而泛黄变质。
【实验探究2】研究小组开展以下实验。
操 作 | 现 象 | 结 论 |
如下图所示,在燃烧匙中放入KI固体,然后分别放置在① ② ③号试管中,数日后观察现象。
| _________ | KI固体在空气中与O2、CO2、H2O共同作用而变质导致碘效降低。 |
【反思提高】
⑴ 讨论后大家认为以上实验方案有所欠缺。甲同学做了补充实验:_____________,数日后观察无明显现象,证明以上结论正确。
⑵ 乙同学推测另一种产物是碳酸盐,请用实验加以证明:______________,证明推测正确。
【拓展应用】生活中鉴别真假加碘盐的方法是:取少量碘盐样品在干净的锅里高温爆炒2分钟,再加入部分未爆炒过的碘盐在碗中混合,加少量白醋,再把刚切好的土豆片浸泡其中,20分钟后若溶液变蓝,则是加碘盐。下列说法不正确的是(_________)
A.实验中土豆片不可用其它食品代替
B.直接将加碘盐放在土豆片上不能呈现蓝色
C.可能是酸性条件下KIO3和KI能反应生成I2
D.烹饪时加醋可能增大食盐中的碘流失
【答案】 碘(I) 甲 带火星的木条伸入试管中复燃 2KIO3 ![]() 2KI+3O2↑ (条件写“高温”也对) ①②号试管中固体无明显变化,③中固体泛黄 其他条件不变,将碘化钾放入装有H2O和 O2的试管中进行对比实验 取适量实验后③号试管内的固体,加入足量稀盐酸,产生气体通入澄清石灰水中,澄清石灰水变浑浊。 A
2KI+3O2↑ (条件写“高温”也对) ①②号试管中固体无明显变化,③中固体泛黄 其他条件不变,将碘化钾放入装有H2O和 O2的试管中进行对比实验 取适量实验后③号试管内的固体,加入足量稀盐酸,产生气体通入澄清石灰水中,澄清石灰水变浑浊。 A
【解析】根据所学知识和题中信息知,食盐中加入碘酸钾的目的是补充微量元素碘,碘是人体必不可缺少微量元素。【提出问题】为什么在汤、菜即将煮好时再加入碘盐才能确保碘效?【猜想假设1】KIO3与KClO3性质类似,受热分解产生O2。【实验探究1】研究小组进行如图11所示实验,宜选用装置甲进行。验证KIO3分解产生氧气的操作和现象为带火星的木条伸入试管中复燃,这是我们检验氧气常用的方法。【得出结论1】KIO3受热同时生成碘化钾(KI),反应方程式为2KIO3 ![]() 2KI+3O2↑。【提出新问题】为什么生成KI就会降低碘效?【实验探究2】研究小组开展以下实验。
2KI+3O2↑。【提出新问题】为什么生成KI就会降低碘效?【实验探究2】研究小组开展以下实验。
操 作 | 现 象 | 结 论 |
如下图所示,在燃烧匙中放入KI固体,然后分别放置在① ② ③号试管中,数日后观察现象。
| ①②号试管中固体无明显变化,③中固体泛黄。 | KI固体在空气中与O2、CO2、H2O共同作用而变质导致碘效降低。 |
【反思提高】⑴ 实验方案有所欠缺。甲同学做了补充实验:其他条件不变,将碘化钾放入装有H2O和 O2的试管中进行对比实验,数日后观察无明显现象,证明以上结论正确。⑵ 乙同学推测另一种产物是碳酸盐,实验证明:取适量实验后③号试管内的固体,加入足量稀盐酸,产生气体通入澄清石灰水中,澄清石灰水变浑浊,这是我们检验碳酸盐常用的方法,二氧化碳可使澄清石灰水变浑浊。【拓展应用】生活中鉴别真假加碘盐的方法是:取少量碘盐样品在干净的锅里高温爆炒2分钟,再加入部分未爆炒过的碘盐在碗中混合,加少量白醋,再把刚切好的土豆片浸泡其中,20分钟后若溶液变蓝,则是加碘盐。A、实验中土豆片可用其它食品代替,凡是含有淀粉的食品均可,淀粉遇碘变蓝,这是我们检验淀粉常用的方法 ,故A错误;B、直接将加碘盐放在土豆片上不能呈现蓝色,使淀粉变蓝的是单质碘,而不是碘酸根离子,故B正确;C、可能是酸性条件下KIO3和KI能反应生成I2,酸性条件下KIO3 和KI能发生氧化还原反应,生成I,故C正确;D、烹饪时加醋可能增大食盐中的碘流失,KIO3受热同时生成碘化钾(KI),酸性条件下KIO3 和KI能发生氧化还原反应,生成I2,碘有毒,不易被人体吸收,故D正确。
点睛∶碘酸钾的化学式是KIO3,是一种白色粉末,熔点560℃。KIO3受热同时生成碘化钾(KI)而被吸收。KI是白色固体,在空气中与O2、CO2、H2O中的两种或三种物质反应生成单质I2而泛黄变质。

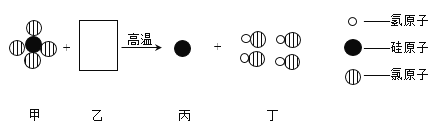
【题目】除去下列各组物质中的少量杂质,所用方法不正确的是:
选项 | 物质 | 杂质 | 除去杂质的方法 |
A | NaCl | Na2CO3 | 加入足量的稀盐酸不再有气体产生,蒸发 |
B | N2 | O2 | 通过红热的铜丝 |
C | KNO3溶液 | Ba(NO3)2 | 滴加适量K2SO4溶液、过滤 |
D | Ca(OH)2 | CaCO3 | 滴入足量稀盐酸至不再产生气体 |
A. A B. B C. C D. D
【题目】当把燃着的小蜡烛放入一个集气瓶中并塞紧胶塞时,蜡烛一会儿就熄灭了。那么,蜡烛为什么会熄灭呢?某化学兴趣小组进行了如下探究,请你填答相关空格。
【提出猜想】猜想Ⅰ:蜡烛燃烧把集气瓶内的氧气耗尽,导致蜡烛熄灭。
猜想Ⅱ:蜡烛燃烧随集气瓶内氧气含量降低而变弱,放出的热量减少,使温度降至蜡烛的____________________以下,导致蜡烛熄灭。
猜想Ⅲ:蜡烛燃烧产生的二氧化碳能灭火,导致蜡烛熄灭。
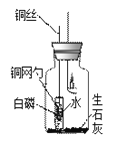
【进行实验】小组设计如下图所示的实验装置,并进行实验来验证猜想。
| 实验操作 | 实验现象 |
点燃蜡烛并连同胶塞上的其它仪器药品一起放入集气瓶中,塞紧胶塞 | 蜡烛火焰逐渐变微弱最终____ | |
蜡烛熄灭并静置冷却后,将铜丝上提,使盛白磷的铜网勺高于试管口,试管倒下,水流出。 | 一会儿后,白磷着火燃烧,有大量____产生 |
【分析及结论】
(1)蜡烛熄灭前,要让白磷浸没在小试管所盛的水中,目的是_________。
(2)集气瓶中装入一些生石灰的设计目的,是让它发生反应提高瓶内的_____,该反应的化学方程式为__________。
(3)瓶内的白磷能燃烧,证明猜想____和____不能成立。我们根据成立的猜想认为,应该把“燃烧需要氧气”这一燃烧发生的条件补充完善为“____________”。