题目内容
【题目】核电荷数为 1~18 的元素的原子结构示意图等信息如下,回答有关问题:
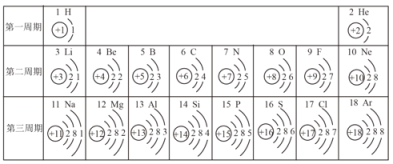
(1)5号元素的元素名称为_____。
(2)仔细观察上表,我们能发现很多规律:同一周期元素原子的_____相同。3表中不同种元素最本质的区别是_____。
(3)原子序数为 12 的元素的原子在化学变化中易_____(填“得”或“失”)电子,形成离子的符号是_____。
(4)第 35 号元素是溴元素,如图为溴原子的原子结构示意图,图中 x 的值为_____,溴元素应该排在_____元素的下方(填序号)。

A.钠 B.硫 C.氯 D.氩
【答案】硼 电子层数 质子数(核电荷数)不同 失 Mg2+ 7 C
【解析】
(1)5号元素的元素名称为硼元素;
(2)同一周期元素原子的电子层数相同;表中不同种元素最本质的区别是质子数不同;
(3)原子序数为12的元素是镁元素,镁原子最外层电子数是2,在化学变化中易失去电子,形成离子的符号是Mg2+;
(4)第35号元素是溴元素,如图 为溴原子的原子结构示意图,图中x的值为:35-2-8-18=7,溴元素应该排在氯元素元素的下方。
为溴原子的原子结构示意图,图中x的值为:35-2-8-18=7,溴元素应该排在氯元素元素的下方。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】“化学反应条件的控制是实验灵魂”。小林和同学在老师指导下,探究了“影响过氧化氢分解速度的因素”。
(实验)
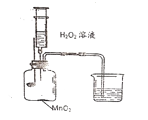
(1)取两支大试管,分别倒入适量的5%、10%的过氧化氢溶液,再加入等量的二氧化锰,各收集一集气瓶气体,发现浓度大的先收集满。该操作过程中合理的排列顺序____________。(选填序号)
①检验装置的气密性 ②旋紧连有导管的单孔塞
③将水槽中待收集气体的集气瓶注满水 ④有连续稳定气泡再排水集气
⑤向大试管内倒入适量过氧化氢溶液再加入少许二氧化锰粉末
(2)取a 、b两支试管加入等体积5%的过氧化氢溶液,再分别加入少许二氧化锰粉末、氧化铜(CuO)粉末,发现a 中比b中产生气泡多且快。随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃。
( 结论)
根据实验(1)(2)得出影响过氧化氢溶液分解的因素是________________、_____________。
(反思) “红砖粉末是否也可以作过氧化氢分解的催化剂?”
(实验)实验步骤和现象如下:
①小林分别向两支试管中加入等质量等浓度的过氧化氢溶液,向其中一支试管加入一药匙红砖粉末,然后将两支试管中的气体通入水中比较产生气泡的快慢,发现加入红砖粉末的试管中反应较快。
②将反应较快的试管内固体过滤出来,洗涤、烘干。
③用烘干后的固体重复步骤①的实验,现象与步骤①完全相同。
试回答:步骤③的实验目的是___________________________。小林认为通过上述实验已证明红砖粉末可以作过氧化氢分解反应的催化剂,但老师认为小林同学的实验还缺少一个关键步骤,请指出来_______________________________________。
(拓展提高)
小林在实验时,联想到了卖鱼卖虾的商贩用过氧化钙(CaO2)增加水池中的含氧量,于是提出如下猜想.
(猜想)过氧化钙与水反应可制取氧气.
实验装置 | 实验主要过程 |
| ①检查装置气密性. ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体.该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出. |
实验结论:过氧化钙与水反应____________(填“能”或“不能”)用于实验室制取氧气.
(分析与反思)
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为商贩用过氧化钙做增氧剂的主要原因是______________________.
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_____________.
(计算)该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示.试计算:

(1)过氧化钙的相对分子质量为_____________;
(2)过氧化钙中钙元素与氧元素的质量比为____________;
(3)过氧化钙与水反应生成氢氧化钙和氧气,______g过氧化钙与37g氢氧化钙含钙量相当;
(4)该产品(如图)中过氧化钙的质量分数至少为_____________.
【题目】学习了氧气的知识,兴趣小组同学对氧气在生活中的应用进行了探究。
(查阅资料)家用制氧机(如图)的工作原理如下:加压时,装填制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气;减压时,分子筛将所吸附的氮气排放,整个过程中,分子筛并不消耗。兴趣小组同学用家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
(一)实验I:小组同学准备通过以下实验验证所收集的气体是否为纯净的氧气。
(实验记录)取一只 250mL 的集气瓶,用排水法收集一瓶所带气体,然后把一根燃着的木条插入集气瓶中,木条燃烧得更旺。
(实验结论)收集的气体是纯净的氧气。
(实验反思)老师指出上述实验并不能证明小组同学所带来的气体一定是纯净的氧气。该实 验不能确定所收集气体为纯净氧气的原因是_____。
(二)实验 II:测定小组同学所带气体中氧气的含量。
同学们在老师的指导下设计了如图所示装置,进行实验,并重复多次。请补充完实验记录。
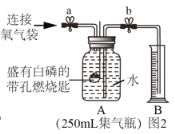
(实验步骤)
①检查_____。
②加入药品,将装置连接固定。
③打开止水夹 a 和 b,向 A 中缓慢鼓入一定量气体,露出白磷后,关闭止水夹a 和b,A 中水进入到 B 中,测得B 中水的体积为V1mL。
④用凸透镜聚光引燃白磷,白磷燃烧,产生大量白烟。
⑤待白磷熄灭并冷却到室温,进行_____操作。B 中水倒吸进入到A 中, 测得量筒中的体积变为V2mL。
⑥计算小组同学所带气体中氧气的体积分数。
(1)下列有关这个实验的说法中,正确的是(______)
A.步骤③中,仰视量筒读数会使测得的 V1 数值偏低;
B.步骤④中,白磷燃烧时要保持关闭止水夹 a 和 b;
C.步骤⑤中,未冷却至室温会使测得的小组同学所带气体中氧气的含量偏高;
D.步骤⑥中,求得氧气的体积分数等于![]()
(2)(数据记录)
经测定 V1=210mL;V2 数据如下:
实验次序 | 1 | 2 | 3 | 4 | 5 |
B 中剩余水体积/mL | 100 | 52 | 49 | 51 | 48 |
(数据处理)已知,在如表数据中,第 1 组数据偏差较大,存在明显误差,在数据处理时应删去。小组同学所带气体中氧气的体积分数为_____%(保留小数点后一位有效数字)
(3)(实验反思)
①家用制氧机制氧气的过程发生的变化属于_____(填“物理变化”或“化学变化”)。
②用高锰酸钾制取氧气的化学方程式_____,由于制取成本较高,不适合大量生产,一般用于实验室制取。
③导致第 1 组数据产生较大误差的可能原因是_____。