题目内容
【题目】如图为某市售大理石标签,但纯度的数据缺失。

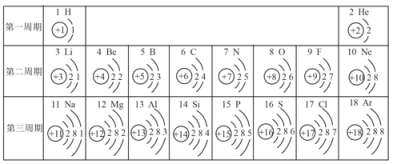
(1)标出碳酸钙中碳元素的化合价__________________;
(2)碳酸钙中Ca、C、O元素的质量比为_____________;
(3)碳酸钙中碳元素的质量分数为__________________;
(4)现用5元购买该大理石制取二氧化碳,得到二氧化碳44g,求该大理石纯度。(已知:杂质中不含碳元素,反应中碳元素完全转化为二氧化碳且反应完全,写出计算过程)_______
【答案】![]() 10:3:12 12% 80%
10:3:12 12% 80%
【解析】
根据化学式意义,质量守恒定律进行分析。
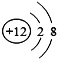
(1)在碳酸钙中,钙元素显+2价,氧元素显-2价,设:碳酸钙中碳元素的化合价为x,根据化合物中元素化合价的代数和为零,则有:(+2)+x+(-2)×3=0, x=+4,碳酸钙中碳元素的化合价表示为:![]() ;
;
(2)碳酸钙中Ca、C、O元素的质量=40:12:(16×3)= 10:3:12;
(3)碳酸钙中碳元素的质量分数=![]() =12%;
=12%;
(4)购买该大理石质量=5÷20×500g=125g;设:生成44g的二氧化碳需要碳酸钙的质量为x;根据“杂质中不含碳元素,反应中碳元素完全转化为二氧化碳且反应完全”和质量守恒定律,则有: ![]() x=100g;大理石纯度=
x=100g;大理石纯度=![]() =80%。
=80%。

练习册系列答案
相关题目