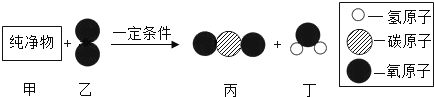
题目内容
【题目】海水是一种重要的自然资源.以下是对海水资源的部分利用.
(1)工业上蒸馏法淡化海水,其原理是利用海水中各成分的_______不同分离出淡水。
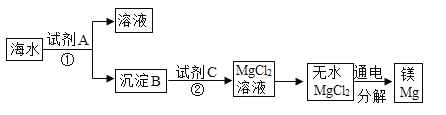
(2)海水中含有丰富的镁资源,如图是从海水中提取镁的简单流程上述过程中,沉淀B与试剂C的反应属于__________(基本反应类型),海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:______________________
(3)下图是工业上利用石灰石、精盐、以氨为媒介进行工业生产纯碱的流程示意图(部分流程、条件及物质未标出):
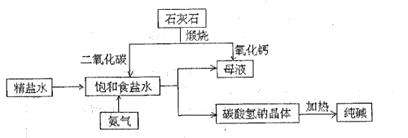
①将氨气通入饱和食盐水中,可制成饱和氨盐水(氨气极易溶于水)。氨盐水比食盐水更容易吸收二氧化碳的原因是_________;
②图中得到碳酸氢钠晶体反应的方程式是____________
③该流程中,能够循环利用的物质有_________(答两种,水除外)
【答案】沸点 复分解 通过步骤①、②得到的MgCl2浓度大,纯度高 氨盐水显碱性而二氧化碳溶于水显酸性,有利于促进反应 NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl NH3、CO2
【解析】
(1)工业上蒸馏法淡化海水,其原理是利用海水中各成分的沸点不同分离出淡水;
(2)图1中,沉淀B与试剂C的反应是氢氧化镁与稀盐酸反应生成了氯化镁和水,属于复分解反应,海水本身就是含有MgCl2的溶液,但浓度较低,通过步骤①、②得到的MgCl2浓度大,纯度高;
(3)①氨盐水比食盐水更容易吸收二氧化碳的原因是氨盐水显碱性而二氧化碳溶于水显酸性,有利于促进反应;
②由图中物质的转化过程可知,得到碳酸氢钠晶体反应的方程式是:NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl;
③由整个生产过程可知,可循环利用的物质为:二氧化碳和氨气。