摘要:7.一定质量的Fe2O3.ZnO.CuO的固体混合粉末.在加热条件下用足量CO还原.得到金属混合物4.82g.将生成的CO2气体用足量的澄清石灰水吸收后.产生l0g白色沉淀.若用2mol·L-1的盐酸溶解该混合物.至少需要盐酸的体积为 A.50 mL B.100 mL C.200 mL D.缺少数据.无法计算 不定项选择题:每题有1-2个正确答案.每题4分.共28分
网址:http://m.1010jiajiao.com/timu_id_4454115[举报]
(2010?丰台区一模)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格内(不用配平).该反应过程中,被氧化与被还原的元素的物质的量之比为
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3.电池正极的电极反应式为
(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为

查看习题详情和答案>>
5:3
5:3
.(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3.电池正极的电极反应式为
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
;正极材料采用了铂网,利用铂网为正极的优点是铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积
.(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol
.(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为
2.016
2.016
L(标准状况).
(2012?吉林一模)为测定FeO和Fe2O3固体混合物中Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成.若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用).请填空:

(1)仪器X的名称是
(2)装置A中发生反应的离子方程式为
(3)装置B中发生反应的化学方程式为
(4)图①-④示装置中与A装置具有相同作用的是
(5)按正确的实验设计,所连接的装置顺序为:A→C→
(6)若FeO和Fe2O3混合物的质量为ag,反应完全后生成水的质量为bg,则混合物中Fe元素的质量分数为
×100%
×100%(用含字母的数学式表示).
查看习题详情和答案>>

(1)仪器X的名称是
长颈漏斗
长颈漏斗
.(2)装置A中发生反应的离子方程式为
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
,实验前检验装置A的气密性的方法是关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气
关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气
.(3)装置B中发生反应的化学方程式为
FeO+H2
Fe+H2O或Fe2O3+3H2
2Fe+3H2O
| ||
| ||
FeO+H2
Fe+H2O或Fe2O3+3H2
2Fe+3H2O
(任写一个即可).
| ||
| ||
(4)图①-④示装置中与A装置具有相同作用的是
①④
①④
(填装置编号).(5)按正确的实验设计,所连接的装置顺序为:A→C→
B
B
→C
C
→C
C
.(6)若FeO和Fe2O3混合物的质量为ag,反应完全后生成水的质量为bg,则混合物中Fe元素的质量分数为
| 1-8b |
| 9a |
| 1-8b |
| 9a |
向一定质量的Cu和Fe2O3的混合物中加入300mL 2mol/L的HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后,无血红色出现.若用过量的CO气体在高温下还原相同质量的此混合物,则固体的质量减少了( )
| A、6.4g | B、4.8g | C、2.4g | D、1.6g |
CoCl2?6H2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2?6H2O的工艺流程如下:
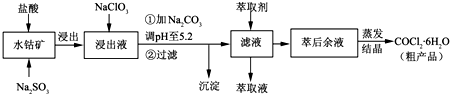
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)NaClO3的作用是
(3)加Na2CO3调pH至5.2所得沉淀为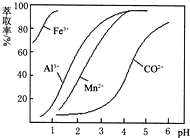
(4)萃取剂对金属离子的萃取率与pH的关系如右图.萃取剂的作用是
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2?6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2?6H2O的质量分数大于100%,其原因可能是
查看习题详情和答案>>

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
.(2)NaClO3的作用是
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
.(3)加Na2CO3调pH至5.2所得沉淀为
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.
(4)萃取剂对金属离子的萃取率与pH的关系如右图.萃取剂的作用是
除去溶液中的Mn2+
除去溶液中的Mn2+
;其使用的适宜pH范围是B
B
.A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2?6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2?6H2O的质量分数大于100%,其原因可能是
粗产品含有可溶性氯化物或晶体失去了部分结晶水
粗产品含有可溶性氯化物或晶体失去了部分结晶水
.(答一条即可)
在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例.某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究.
实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是 (选填序号:A.NaOH B.盐酸C.酒精).
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是: .
乙同学认为是O2,其可能的理由是: .
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是 .
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为: .
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为: mol/L;铁钉中单质铁的质量分数为 .
查看习题详情和答案>>
实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是:
乙同学认为是O2,其可能的理由是:
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为:
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 再投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |