摘要:根据图示回答下列问题: (1)写出A.E.G的结构简式:A .E .G , (2)反应②的化学方程式是 . 反应④化学方程式是 , (3)写出①.⑤的反应类型:① .⑤ .
网址:http://m.1010jiajiao.com/timu_id_4448405[举报]
(2010?海南模拟)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
(1)装置1中玻璃仪器的名称是
(2)若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
(3)若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
(4)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:
查看习题详情和答案>>

(1)装置1中玻璃仪器的名称是
分液渥斗
分液渥斗
,锥形瓶
锥形瓶
;装置2的作用是除去Cl2中带有的HCl气体
除去Cl2中带有的HCl气体
.(2)若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
2Na+2CO2=Na2CO3+CO
2Na+2CO2=Na2CO3+CO
;(3)若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
4Na+3CO2=2Na2CO3+C
4Na+3CO2=2Na2CO3+C
;(4)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:
将4中固体加足量水,有不溶黑色固体,则生成物中有C
将4中固体加足量水,有不溶黑色固体,则生成物中有C
.(2007?揭阳二模)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O
乙+丙 b.乙
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是:
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
丙.则:
①甲的结构式为
②写出上述反应的化学方程式
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式
查看习题详情和答案>>
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O
| △ |
| △ |
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是:
第四周期,第Ⅷ族
第四周期,第Ⅷ族
.②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:
AlCl3+3H2O
Al(OH)3↓+3HCl↑
| ||
AlCl3+3H2O
Al(OH)3↓+3HCl↑
.
| ||
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为
Al-3e-+4OH-=AlO2-+2H2O
Al-3e-+4OH-=AlO2-+2H2O
.(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
| 高温 |
①甲的结构式为
O=C=O
O=C=O
.②写出上述反应的化学方程式
CO2+C
2CO
| ||
CO2+C
2CO
.
| ||
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式
3CO2+4OH-=2HCO3-+CO32-+H2O
3CO2+4OH-=2HCO3-+CO32-+H2O
.(2007?广州一模)某草酸亚铁样品中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O.
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml.
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后(不含Fe3+),继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml.
③
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.
Ⅱ.用高锰酸钾标准溶液润洗滴定管;
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有
(4)某实验探究小组的一次测定数据记录如下:
根据数据计算0.1582g 样品中:n(Fe2+)=
查看习题详情和答案>>
5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O.
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml.
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后(不含Fe3+),继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml.
③
重复以上实验1-2次
重复以上实验1-2次
.④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是
重复以上实验1-2次
重复以上实验1-2次
.(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.
检验活塞是否漏液
检验活塞是否漏液
;Ⅱ.用高锰酸钾标准溶液润洗滴定管;
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ.
调节液面至“0”刻度以下
调节液面至“0”刻度以下
.(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有
KSCN
KSCN
溶液的试管中,如溶液中没有出现血红色
溶液中没有出现血红色
,则说明溶液合格.(4)某实验探究小组的一次测定数据记录如下:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1582 | 0.00 | 29.90 | 40.90 |
| 0.1582 | 0.00 | 30.10 | 41.10 |
| 0.1582 | 0.00 | 32.10 | 43.10 |
0.001100mol
0.001100mol
; n(C2O42-)=0.001000mol
0.001000mol
;FeC2O4(FeC2O4 的摩尔质量为144g/mol)的质量分数为86.5%
86.5%
.(精确到0.1%)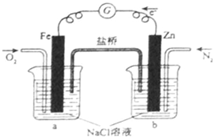 (2011?海南)根据图,下列判断中正确的是( )
(2011?海南)根据图,下列判断中正确的是( )