摘要:(一)抑制FeCl3水解 1.实验室如何配制FeCl3溶液? 为了抑制FeCl3水解.将FeCl3固体溶于较浓的盐酸中.然后用蒸馏水稀释至所需要的浓度. 2.加热FeCl3溶液能得到无水FeCl3固体吗?如何得到无水FeCl3固体? FeCl3溶液中存在FeCl3的水解平衡.加热促进其水解.又由于生成的氯化氢气体不断挥发.使水解趋于完全.生成的Fe(OH)3在灼烧时发生分解反应2Fe(OH)3 Fe2O3十3H2O.最终得到的是Fe2O3.而得不到无水FeCl3固体. 要想得到无水FeCl3固体.需要抑制FeCl3水解.可以将FeCl3溶液在HCl气流中蒸干.
网址:http://m.1010jiajiao.com/timu_id_4435992[举报]
(2013?朝阳区二模)由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O
(1)①中产生气体的电子式是
(2)用离子方程式表示过程②中稀硝酸的作用
Ⅱ.由FeCl3?6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3?6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3)SOCl2与水接触会迅速产生白雾和SO2.加热分解FeCl3?6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因
(4)过程ⅱ中产生FeCl2的化学方程式是
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
(5)下列说法正确的是
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是
查看习题详情和答案>>
Ⅰ.按下图所示过程制备FeCl3?6H2O

(1)①中产生气体的电子式是
H:H
H:H
.(2)用离子方程式表示过程②中稀硝酸的作用
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
,在该过程中要不断向溶液中补充盐酸,目的是补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质
补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质
.Ⅱ.由FeCl3?6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3?6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3)SOCl2与水接触会迅速产生白雾和SO2.加热分解FeCl3?6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因
6SOCl2+FeCl3?6H2O═FeCl3+12HCl↑+6SO2↑生成的HCl会抑制FeCl3的水解得到无水FeCl3
6SOCl2+FeCl3?6H2O═FeCl3+12HCl↑+6SO2↑生成的HCl会抑制FeCl3的水解得到无水FeCl3
.(4)过程ⅱ中产生FeCl2的化学方程式是
2FeCl3+H2
2FeCl2+2HCl
| ||
2FeCl3+H2
2FeCl2+2HCl
.
| ||
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
ac
ac
.a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是
4FeCl2+H2O+O2
2FeCl3+Fe2O3+2HCl
| ||
4FeCl2+H2O+O2
2FeCl3+Fe2O3+2HCl
.
| ||
请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素.
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水.
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:
(2)针对FeCl3水解的影响因素提出假设:
假设 l:溶液的酸碱性;
假设 2:
假设 3:
(3)基于以上3个假设,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中.
查看习题详情和答案>>
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水.
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.(2)针对FeCl3水解的影响因素提出假设:
假设 l:溶液的酸碱性;
假设 2:
氯化铁溶液的浓度
氯化铁溶液的浓度
;假设 3:
溶液的温度
溶液的温度
.(3)基于以上3个假设,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中.
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入2mllmol/L氯化铁,观察溶液颜色,加热一段时间. 在试管中加入2mllmol/L氯化铁,观察溶液颜色,加热一段时间. |
加热后溶液颜色变深.说明升温促进氯铁水解, 生成更多的氢氧化铁胶体. 加热后溶液颜色变深.说明升温促进氯铁水解, 生成更多的氢氧化铁胶体. |
| ② | 在上述溶液中通入HCl气体 在上述溶液中通入HCl气体 |
上述溶液颜色变浅.说明加入酸使平衡左移,酸抑制氯化铁水解. 上述溶液颜色变浅.说明加入酸使平衡左移,酸抑制氯化铁水解. |
| ③ | 用量筒取10mllmol/L氯化铁于烧杯中,用pH计测出pH值.另取90ml蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值. 用量筒取10mllmol/L氯化铁于烧杯中,用pH计测出pH值.另取90ml蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值. |
前后测得pH值之差小于1.说明加水稀释后平衡右移,生成更多的H+.故增大氯化铁浓度,不利其水解. 前后测得pH值之差小于1.说明加水稀释后平衡右移,生成更多的H+.故增大氯化铁浓度,不利其水解. |
无 无 |
无 无 | |
| … | … | … |
(2012?门头沟区一模)无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是C)为原料制备无水AlCl3的工艺(碳氯化法)流程如下:
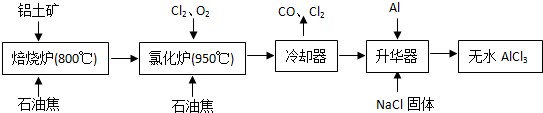
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为
(3)升华器中主要含有AlCl3和FeCl3,需加入一定量Al,其目的是
(4)为测定制得的无水AlCl3产品(含少量FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①此过程涉及反应的离子方程式为
②AlCl3产品的纯度为
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3?6H2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl3,其原因是
查看习题详情和答案>>

(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为
A12O3+3C12+3C
2A1C13+3CO
| ||
A12O3+3C12+3C
2A1C13+3CO
.
| ||
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为
SO32-+C12+H2O═SO42-+2C1-+2H+
SO32-+C12+H2O═SO42-+2C1-+2H+
.(3)升华器中主要含有AlCl3和FeCl3,需加入一定量Al,其目的是
除去FeCl3
除去FeCl3
.(4)为测定制得的无水AlCl3产品(含少量FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①此过程涉及反应的离子方程式为
Fe3++3OH-=Fe(OH)3↓
Fe3++3OH-=Fe(OH)3↓
、Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.②AlCl3产品的纯度为
96%
96%
.(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3?6H2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl3,其原因是
Al3++3H2O?Al(OH)3+3H+,抑制AlCl3水解
Al3++3H2O?Al(OH)3+3H+,抑制AlCl3水解
.(2011?南京三模)组蛋白去乙酰化酶(HDAC)抑制剂能激活抑癌基因,从而抑制肿瘤细胞生长,诱导肿瘤细胞凋亡.下面是一种HDAC抑制剂(F)的合成路线:

已知①同一个碳原子上连接2个羟基的结构不稳定,会失去一个水分子
②羟基直接与碳碳双键相连不稳定:R-CH=CH-OH→R-CH2-CHO

(1)写出A转化为B的化学方程式
 .
.
(2)写出E中2种含氧官能团的名称
(3)B到C的转化过程中,还生成一种小分子,其分子式为
(4)写出D的结构简式
 .
.
(5)写出符合下列条件的B的同分异构体的结构简式
 .
.
a.苯环上有3个互为间位的取代基,且有一个为甲基;
b.能与FeCl3溶液发生显色反应;
c.不能发生银镜反应,但水解产物能发生银镜反应.
(6)写出以对甲基苯酚 ,)和乙炔为主要原料制备化合物A的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
,)和乙炔为主要原料制备化合物A的合成路线流程图(无机试剂任选).合成路线流程图示例如下:

 .
.
查看习题详情和答案>>

已知①同一个碳原子上连接2个羟基的结构不稳定,会失去一个水分子
②羟基直接与碳碳双键相连不稳定:R-CH=CH-OH→R-CH2-CHO

(1)写出A转化为B的化学方程式


(2)写出E中2种含氧官能团的名称
酯基、醚基
酯基、醚基
.(3)B到C的转化过程中,还生成一种小分子,其分子式为
HF
HF
.(4)写出D的结构简式


(5)写出符合下列条件的B的同分异构体的结构简式


a.苯环上有3个互为间位的取代基,且有一个为甲基;
b.能与FeCl3溶液发生显色反应;
c.不能发生银镜反应,但水解产物能发生银镜反应.
(6)写出以对甲基苯酚
 ,)和乙炔为主要原料制备化合物A的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
,)和乙炔为主要原料制备化合物A的合成路线流程图(无机试剂任选).合成路线流程图示例如下:

