网址:http://m.1010jiajiao.com/timu_id_4435030[举报]
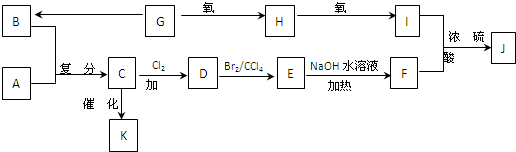
已知:F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;J的化学式为C9H14O6.物质转化关系如图所示:

请回答下列问题:
(1)请写出下列物质的结构简式:A.______,J.______.
(2)写出 C→D的化学方程式:______,该反应的反应类型是______,G→B的反应类型是______.
(3)A与A的所有烯烃同分异构体之间,通过烯烃复分解反应后形成的新烯烃有______种结构;这些新烯烃和氯化氢在一定条件下发生加成反应,则其产物只有一种结构的新烯烃的结构简式为:CH2=CH2、______、______.
(4)以G为原料经过一系列反应最终可制得乙酰乙酸乙酯(无色液体),通常状况下乙酰乙酸乙酯可逐渐转化为烯醇式 (达到平衡后烯醇式约占7%):

已知FeCl3溶液可和烯醇式反应显紫色.某同学拟用5%的FeCl3溶液和Br2的CCl4溶液来证明上述平衡的存在,请简要描述实验过程和现象______.
查看习题详情和答案>>
 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2已知:F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;J的化学式为C9H14O6.物质转化关系如图所示:
请回答下列问题:
(1)请写出下列物质的结构简式:A.


(2)写出 C→D的化学方程式:
(3)A与A的所有烯烃同分异构体之间,通过烯烃复分解反应后形成的新烯烃有


(4)以G为原料经过一系列反应最终可制得乙酰乙酸乙酯(无色液体),通常状况下乙酰乙酸乙酯可逐渐转化为烯醇式 (达到平衡后烯醇式约占7%):
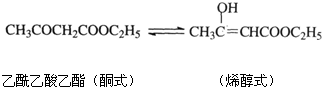
已知FeCl3溶液可和烯醇式反应显紫色.某同学拟用5%的FeCl3溶液和Br2的CCl4溶液来证明上述平衡的存在,请简要描述实验过程和现象
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,
在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
图1 图2
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | _ | _ | 10 |
| ⅲ | 480 | _ | 10 |
B.根据反应N2+ 3H2
 2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看习题详情和答案>>
2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看习题详情和答案>>
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,
在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
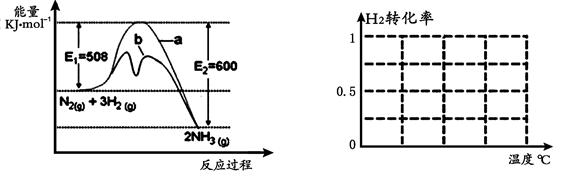
图1 图2
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T(℃) |
n (N2)/n(H2) |
P(MPa) |
|
ⅰ |
450 |
1/3 |
1 |
|
ⅱ |
_ |
_ |
10 |
|
ⅲ |
480 |
_ |
10 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应N2+ 3H2 2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看习题详情和答案>>
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
图1 图2
 [
[
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | _ | _ | 10 |
| ⅲ | 480 | _ | 10 |
A.请在上表空格中填入剩余的实验条件数据。
 B.根据反应N2+ 3H2
B.根据反应N2+ 3H2![]() 2NH3的特点,在给出的坐标图2中,
2NH3的特点,在给出的坐标图2中,
画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
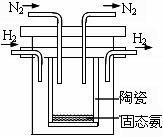
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式 。
查看习题详情和答案>>