网址:http://m.1010jiajiao.com/timu_id_4432301[举报]
 [化学-物质结构与性质]
[化学-物质结构与性质]第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
(1)①H、C、N、O四种元素的电负性由小到大的顺序为
②下列叙述不正确的是
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4-中不存在
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与CN_互为等电子体的单质分子式
③三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁的晶体类型为
(3)①Ti的在周期表中位置
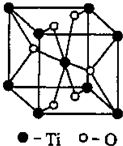
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为
(Ⅰ)“化学――人类进步的关键”。日常生活、社会生产中的许多问题都涉及到化学知识。下列有关说法中正确的是(填序号,多选倒扣分)___________________________________________。
A、冰的密度小于液态水,氨易液化,均与氢键有关
B、明矾净水,血液透析,均与胶体知识有关
C、从经济效益等方面综合考虑,硫酸厂在常压和合适温度下催化氧化SO2,且应在距离原料产地近的地方建厂
D、我国生产硫酸的主要原料是黄铁矿、水、空气
E、生产水泥、玻璃的共同原料是石灰石
F、用除去油污的废铁屑与过量的稀硫酸制备绿矾(FeSO4?7H2O)
G、晶体硅常用作光导纤维材料
H、氯碱工业中用阳离子交换膜将电解槽分为阳极室和阴极室,精制饱和食盐水送入阴极室
I、干冰、溴化银常用于人工降雨
J、硫酸铜晶体中结晶水含量测定实验中至少加热2次,称量4次
(Ⅱ)、某无色混合气体可能含有CO2、CO、H2O(气)、H2中的一种或几种,依次进行如下处理(假定每步处理均反应完全)。(1)通过碱石灰时,气体体积变小;(2)通过赤热的CuO时,固体变为红色;(3)通过白色CuSO4粉末时,粉末变为蓝色;(4)通过澄清的石灰水时,溶液变浑浊。由此可以确定原混合气体的成分可能是(已给出一种可能,还有几种可能就填几种,可不填满)。CO、H2、CO2、、______________、_______________、_______________、_____________、_____________。
查看习题详情和答案>>(1)良好的生态环境可以提升生活质量.
①近两年来,全国多个省市出现严重的雾霾天气.导致雾霾形成的主要污染物是
a.SO2 b.NO2 c.CO2 d.PM2.5
②以下物质垃圾不属于“
 ”标志的是
”标志的是a.废报纸 b.废铝制的易拉罐 c.烟蒂、渣土
③综合利用“地沟油”的一种方法是将它水解以获取高级脂肪酸和
(2)人体健康与食品、药物等关系密切.
①生活中应合理地摄取人体必需的元素,体内
a.感冒发烧 b.细菌感染 c.胃酸过多
②小苏打可用来治疗胃酸过多,请写出该反应的离子方程式:
③维生素C是生命活动的重要物质.在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的
④糖类、油脂、蛋白质都是人体必需的营养物质.其中蛋白质被摄入人体后,在酶的作用下水解为
(3)材料是人类赖以生存和发展的重要物质基础.
①在下列材料中,属于无机非金属材料的是
a.硬币 b.聚氯乙烯塑料 c.氮化硅陶瓷
②硅酸盐水泥是常用的建筑材料,它主要是以
③晶体硅是半导体材料,二氧化硅是光纤的主要成分,晶体硅和二氧化硅都属于
④橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为
⑤钢铁的生产与使用是人类文明和生活进步的一个重要标志.工业炼铁原理的主要化学反应方程式为
钢铁的腐蚀主要是由
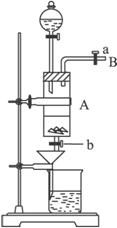
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是__________________________________________________________________。
(2)烧杯内放过量稀HNO3的原因是_______________________________________________,
发生反应的离子方程式是________________________________________________。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是________
____________________________________________________________________。
(4)利用这个装置进行实验,你认为该实验存在的缺点可能有:
__________________________,__________________________。(写两条即可)
(5)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是_____________。(填序号)①适量氯气 ②适量过氧化氢和稀盐酸 ③高锰酸钾酸性溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是__________________________
_____________________________________________________________________。
查看习题详情和答案>>Ⅰ.某化学兴趣小组探究饱和氯水与石灰石的反应,并制取较浓的HClO溶液和对所得溶液中的部分阴离子进行检验.
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
(2)步骤2、步骤3的实验目的都是______,为达到该实验目的,还可以采取的方法是______.
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:______.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:______.
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:______(填序号). 查看习题详情和答案>>