摘要:基本方法主要有1.观察法 ①含义:是一种有计划.有目的地用感官考察研究对象的方法. ②观察的具体内容:主要是用肉眼观察物质的颜色.状态.各种变化等.用鼻子闻物质的气味.用耳朵听声音.用触觉去感受温度.硬度.弹性.韧性等等.还包括借助一些仪器来进行观察.提高观察的灵敏度. ③应用观察法研究物质的性质的实例:观察金属钠的物理性质及钠与水反应的现象.
网址:http://m.1010jiajiao.com/timu_id_4422863[举报]
A和甲是来自石油和煤的两种基本化工原料.A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.
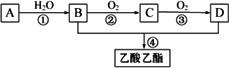
(1)A分子的电子式是________;C的分子式是________.
(2)在反应①~④中,属于加成反应的是________(填序号).
(3)B和D反应进行比较缓慢,提高该反应速率的方法主要有________________;写出反应④的化学反应方程式:________.
(4)可用于鉴别B、D和甲的一种试剂是________.
(1)某有机物的结构简式为HO-CH2CH=CHCH2-COOH,写出该有机物含有官能名称
从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(2)海水淡化的方法主要有
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为
查看习题详情和答案>>
羟基
羟基
,碳碳双键
碳碳双键
,羧基
羧基
,该有机物可能发生的化学反应是②③④
②③④
,(填序号)①水解 ②酯化 ③加成 ④氧化.从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(2)海水淡化的方法主要有
蒸馏法
蒸馏法
(填一种).(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为
Cl2+2Br-=Br2+2Cl?
Cl2+2Br-=Br2+2Cl?
.工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等.高温煅烧还原法的工艺流程可简单的表示如下:
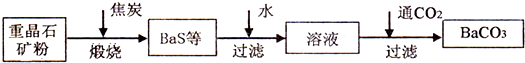
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=-1473.2kJ?mol-1
Ba(s)+S(s)=BaS(g)△H=-460kJ?mol-1
请回答:
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为 .
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是 .
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为 .
②与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有 .
③已知:Ksp(BaCO3)=2.8×10-9,Ksp(BaSO4)=1.07×10-10.现欲用沉淀转化法将0.39mol BaSO4全部转化为BaCO3,如每次用1.00L 2.0mol?L-1Na2CO3溶液处理,至少需要处理 次才能达到目的.
查看习题详情和答案>>

已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=-1473.2kJ?mol-1
Ba(s)+S(s)=BaS(g)△H=-460kJ?mol-1
请回答:
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
②与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有
③已知:Ksp(BaCO3)=2.8×10-9,Ksp(BaSO4)=1.07×10-10.现欲用沉淀转化法将0.39mol BaSO4全部转化为BaCO3,如每次用1.00L 2.0mol?L-1Na2CO3溶液处理,至少需要处理
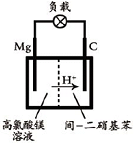 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:①电解无水氯化镁法,②碳或碳化钙热还原法,③皮江法.
已知:
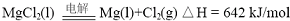
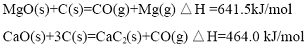
(1)写出MgO(s)与CaC2(s)作用生成Mg(g)及CaO(s)及C(s)的热化学方程式:
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
.(2)碳化钙还原氧化镁的文献资料如表2
表2 还原剂的用量与温度、保温时间计MgO还原率
| n(CaC2)/N(MgO) | 还原温度/℃ | 恒温时间/h | 还原率/% |
| 1.1 | 1110 | 2.0 | 62 |
| 1.1 | 1150 | 2.0 | 80 |
| 1.1 | 1150 | 2.5 | 85 |
| 1.2 | 1000 | 2.0 | 33 |
| 1.2 | 1150 | 2.0 | 84 |
| 1.2 | 1150 | 2.5 | 88 |
| 1.3 | 1150 | 2.0 | 86 |
| 1.3 | 1150 | 2.0 | 88 |
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
;采用n(CaC2)/n(MgO)配比为1.2,而不是1.3,其主要原因是:相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
.(3)用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离反应:Mg(OH)Cl=Mg(OH)++Cl-.电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为
2Mg(OH)++2e-=MgO+H2↑
2Mg(OH)++2e-=MgO+H2↑
.实验室由MgCl2?6H2O制取无水氯化镁可采用的方法是在氯化氢气流中加热脱水
在氯化氢气流中加热脱水
.(4)我国目前生产金属镁主要用皮江法生产,其原料为白云石(MgCO3?CaCO3)的煅烧产物和硅铁(含75%Si).其生产原理为:
2CaO+2MgO(s)+Si(s)
| 1100-1250℃ |
| 真空 |
防止硅和镁被氧化,并提高金属镁的产率
防止硅和镁被氧化,并提高金属镁的产率
.(5)镁/间-二硝基苯电池的装置如图所示,电池工作时镁转变为氢氧化镁,间-二硝基苯则转变为间-二苯胺.该电池正极的电极反应式为

