网址:http://m.1010jiajiao.com/timu_id_4383042[举报]
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
查看习题详情和答案>>
①反应开始时两者生成H2的速率 。?
②等物质的量浓度的NaX和NaY溶液的碱性,NaX NaY(填“>”“<”或“=”);理由是:? ?。?
(2)某研究性学习小组的同学,取一定质量纯净的Na2SO3固体,隔绝空气600 ℃以上强热,得固体A,经测定强热前后固体质量保持不变。为进一步证明Na2SO3固体在强热条件下是否分解以及该条件下分解是否完全,他们对A进行如下实验:?

依据实验现象以及质量守恒定律和氧化还原反应的有关规律,他们推测固体A的成分可能是Na2SO4、Na2SO3、Na2S2O3、Na2S和Na2O中的数种,并且提出以下两种假设。?
试回答下列问题:?
假设1:①A溶液碱性比Na2SO3溶液碱性强,是由于生成的Na2S水解所致,则Na2SO3固体分解的化学反应方程式为: 。?
②若气体C是H2S,判断Na2SO3固体分解是否完全 (填“是”或“否”),你判断的理由是: 。?
假设2:③A溶液碱性比Na2SO3溶液碱性强,是由于生成的Na2O溶于水所致,则Na2SO3固体分解的化学反应方程式为:(未平配)?
□Na2SO3——□ Na2S2O3+□ Na2SO4+□ Na2O,请配平该化学反应方程式。?
④为进一步确定何种假设正确,该小组同学查阅有关资料得知,Na2S2O3不稳定,受热易分解,请你帮助判断上述何种假设正确 。?
查看习题详情和答案>>一些盐的结晶水合物,在温度不太高时就有熔化现象,既熔溶于自身的结晶水中,又同时吸收热量。它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
| Na2S2O3?5H2O | CaCl2?6H2O | Na2SO4?10H2O | Na2HPO4?12H2O |
熔点(℃) | 40.50 | 29.92 | 32.38 | 35.1 |
熔化热(kJ/mol) | 49.7 | 37.3 | 77 | 100.1 |
(1)上述潜热材料中最适宜应用的两种盐是(用化学式表示) 。
(2)实际应用时最常采用的(由来源和成本考虑)应该是 。
查看习题详情和答案>>|
己知25 mL 0.1 mol/L Na2S2O3溶液恰好把224 mL Cl2(标准状况)完全反应为Cl-,则S2O32-将转化为 | |
A. |
S2- |
B. |
S |
C. |
SO32- |
D. |
SO42- |
某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O,他们设计如图所示装置制取氯气并验证其性质的实验.
2CaSO4+2Cl2↑+2H2O,他们设计如图所示装置制取氯气并验证其性质的实验.

试回答(1)该实验中A部分的装置是________(填写装置的序号)
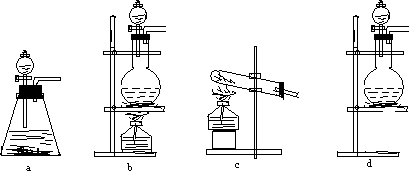
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤)______________________.
(3)写出在D装置中发生反应的离子方程式__________________.
(4)该实验存在明显的缺陷,请你提出改进的办法____________.
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1 mol·L-1 Na2S2O3溶液反应生成的碘,已知反应式为2Na2S2O3+I2=Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 20 mL.则漂白粉中Ca(ClO)2的质量分数为________________.