摘要:12. 80℃.101.3千帕下.用下图装置进行如下实验.A.C两筒内分别装有无色气体.它们可能是NH3.O2.N2.H2S.NO.CO2等气体.B管内装有固体.推动A的活塞使A筒中的气体缓缓地全部通过B进入C筒.C中的气体由无色变成红棕色.但其体积换算成同温同压下却并未变化. (1)C中发生的反应.其化学方程式是 .已知原C中的气体为单一气体.它是 .(若有多种可能答案.需一一列出.)将反应后C筒中的气体.用水吸收后.气体体积.减小一半.则与水反应前C中的气体是 .(若有多种答案需一一列出.) (2)若实验开始前A.C中的气体体积分别为1.40L和2.24L.且A中的气体经过B管后.B管增重1.40g.通过计算和推理可判定A中的气体是 .其质量是 g. 分析:本题要求学生将分子量.物质的量.气体摩尔体积.化学方程式计算与元素及其化合物的性质结合起来.根据试题给出的条件.进行分析.推理和论证. (1)由C筒中发生的化学现象气体由无色变为红综色.可判断C中发生的化学反应为:2NO+O2=2NO2,又根据C筒中的气体反应后并无体积变化.可知C中为NO.由B管进入C中气体为纯O2.反应后O2并未过量.与水反应后.气体体积减半.已知与水反应前C筒中的气体为NO2和NO的混合气. (2)设与水反应前C筒中NO2的体积为.NO为 .根据题意列方程组: 由B管进入C筒中的 若0.84L O2全部由A筒中来.则A中除O2外.另一种气体的体积为1.40-0.84=0.56L.根据B管增重1.40g.该气体的mol尔质量为: 对照试题所给出的已知气体中没有一种气体的mol尔质量等于或大于56g/mol.因此该气体不是其中的一种.也不可能是其中两种或多种的混合气.由此可以确定C筒的O2可能全部或部分是由A中的某气体跟B管中的固体反应而得.已知气体能跟固体反应生成O2的只有CO2: 讨论:(1)若A中的气体全部是CO2(即进入C的O2全部由CO2和Na2O2反应而得.)根据反应方程式1.40L CO2与反应生成O2的体积为(L)这与进入C筒中O2的体积不符. (2)若A中的气体是CO2和O2的混合气.设A中CO2和O2的体积分别为. 根据题意 解题: 该结果与题设条件相符.所以A中的气体是CO2和O2的混合气体. A中的气体的质量.
网址:http://m.1010jiajiao.com/timu_id_4383035[举报]
80℃,101.3 kPa下,用图86装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2固体,推动A的活塞使A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化(不考虑2NO2 N2O4)。?
N2O4)。?
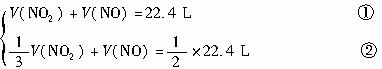
图8-6?
(1)C中发生的反应,其化学方程式是 。已知原C中的气体是单一气体,它是 ,理由是 。?
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前 C中的气体是 。?
(3)若实验开始前A、C中气体体积(换算成标准状况)分别为?
80℃,101.3 kPa下,用图86装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2固体,推动A的活塞使A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化(不考虑2NO2![]() N2O4)。?
N2O4)。?
![]()
图8-6?
(1)C中发生的反应,其化学方程式是 。已知原C中的气体是单一气体,它是 ,理由是 。?
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前 C中的气体是 。?
(3)若实验开始前A、C中气体体积(换算成标准状况)分别为?1.40 L? 和2.24 L,且A中的气体经过B管后,B管增重了?1.40 g?。经计算和推理可判定A中的气体是 ,其质量为 g(不必写出计算和推理过程)。?
查看习题详情和答案>>(2009?江门一模)氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为
(2)K3[Fe(CN)6]晶体中Fe3-与CN-之间的键型为
(3)NH4+中氮原子的杂化类型为
(4)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
请回答下列有关问题:
①估计钙元素的电负性的取值范围:
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中形成的化学键的类型及其理由是
查看习题详情和答案>>
(1)砷原子核外电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
.(2)K3[Fe(CN)6]晶体中Fe3-与CN-之间的键型为
配位键
配位键
,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)
CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)
.(3)NH4+中氮原子的杂化类型为
sp3
sp3
,NH4+的空间构型为正四面体
正四面体
.(4)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
;②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3
C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3
;结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
HF
HF
先液化.(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
①估计钙元素的电负性的取值范围:
0.8
0.8
<X<1.2
1.2
.②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中形成的化学键的类型及其理由是
共价键,因为AlCl3中氯与铝的电负性差值为1.5,小于1.7,故AlCl3中化学键类型为共价键
共价键,因为AlCl3中氯与铝的电负性差值为1.5,小于1.7,故AlCl3中化学键类型为共价键
.随着环保意识增强,清洁能源越来越受到人们关注.
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(1)=H2O(g)△H=+44.0kJ?mol-1
则4.8g甲烷气体完全燃烧生成液态水,放出热量为
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
则此时正、逆反应速率的关系是
A.v(正)>v(逆) B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中t=
设计实验2、3的目的是
实验l、2、3中反应的化学平衡常数的大小关系是
(3)利用催化剂,通过两步反应可将水分解制得氢气,若第一步反应为:MnFe2O4
MnFe2O4-x+
□↑,则框内物质为
第二步反应的化学方程式为
查看习题详情和答案>>
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(1)=H2O(g)△H=+44.0kJ?mol-1
则4.8g甲烷气体完全燃烧生成液态水,放出热量为
267.1kJ
267.1kJ
.(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)
 CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
| CH4 | H2O | CO | H2 |
| 3.0mol?L-1 | 8.5mol?L-1 | 2.0mol?L-1 | 2.0mol?L-1 |
A
A
.(填下列相关选项的字母符号)A.v(正)>v(逆) B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol?L-1 | H2O初始浓度/mol?L-1 | K |
| 1 | 360 | P | 2.00 | 6.80 | K1 |
| 2 | t | 101 | 2.00 | 6.80 | K2 |
| 3 | 360 | 101 | 2.00 | 6.80 | K3 |
480
480
,P=303
303
;设计实验2、3的目的是
探究温度对化学反应速率的影响
探究温度对化学反应速率的影响
;实验l、2、3中反应的化学平衡常数的大小关系是
K2>K1=K3
K2>K1=K3
(用K1、K2、K3表示).(3)利用催化剂,通过两步反应可将水分解制得氢气,若第一步反应为:MnFe2O4
| ||
| x |
| 2 |
O2
O2
;第二步反应的化学方程式为
xH2O+MnFe2O4-x=MnFe2O4+xH2↑
xH2O+MnFe2O4-x=MnFe2O4+xH2↑
(可不写反应条件).
亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新方法得到发展.生产流程如图1所示:
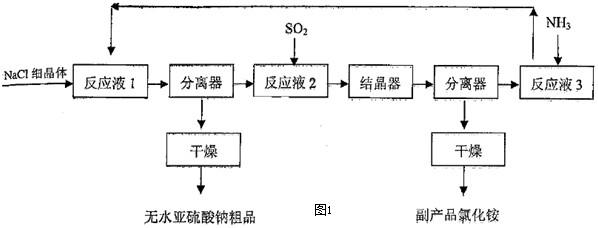
(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是: ;所需玻璃仪器有 .
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为 .
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有 ;在“反应液3”中通入足量NH3的目的是: .
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
副产品NH4Cl的理论值a为: ;它与NH4Cl实际值有差别的可能原因是: .
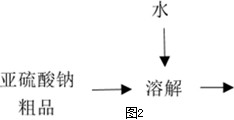
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).
 查看习题详情和答案>>
查看习题详情和答案>>

(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是:
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
| 原料 | 理论值 | 实际值 | 利用率 |
| SO2 | 50.79 | 54.4 | 93.36% |
| NaCl | 92.86 | 101.0 | 91.94% |
| NH3 | 26.98 | 30.5 | 88.46% |
| 副产品NH4Cl | a | 87.1 | -------- |
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).
 查看习题详情和答案>>
查看习题详情和答案>>