摘要:审题不够仔细,
网址:http://m.1010jiajiao.com/timu_id_4383016[举报]
为了防止生锈,可对铁制品表面进行“发蓝”处理,把铁制品浸入热的NaNO2、NaNO3、NaOH混合溶液中,使它的表面氧化成一层致密的Fe3O4氧化膜(Fe3O4可看作Fe2O3与FeO的复合氧化物),所发生的反应可表示如下:
①3Fe+NaNO2+5NaOH====3Na2FeO2+NH3↑+H2O
②□Fe+□NaNO3+□NaOH+□![]() →□Na2Fe2O4+□NH3↑
→□Na2Fe2O4+□NH3↑
③Na2FeO2+Na2Fe2O4+2H2O?Fe3O4+4NaOH
(1)请配平②的化学方程式,将结果填入②的方框内.
(2)Na2FeO2称亚铁酸钠,Na2Fe2O4名称为________.
(3)若上述热的混合液中NaOH含量太少,则氧化膜的厚度也太薄,其原因可能是_____________________.
单质与酸反应的有关计算,如果借助数学思维方法,可使化学问题简单化,提高审题、解题的能力和速度.
查看习题详情和答案>>
三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]?3H2O)有很重要的用途.可用如图流程来制备.根据题意完成下列各题:
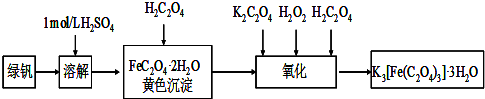
(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)步骤2中,加入锌粉的目的是
(5)步骤3中,发生反应的离子方程式为:
(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量
(7)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式
查看习题详情和答案>>

(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中
铁
铁
(填物质名称)往往要过量,理由是防止Fe2+被氧化
防止Fe2+被氧化
.(2)要从溶液中得到绿矾,必须进行的实验操作是
bcae
bcae
.(按前后顺序填)a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
250ml容量瓶
250ml容量瓶
;主要操作步骤依次是:称量、溶解、转移、洗涤
洗涤
、定容、摇匀.(4)步骤2中,加入锌粉的目的是
还原Fe3+为Fe2+
还原Fe3+为Fe2+
.(5)步骤3中,发生反应的离子方程式为:
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
.(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量
偏高
偏高
.(选填“偏低”、“偏高”、“不变”)(7)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式
2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO+5CO2
2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO+5CO2
.附加题:2molSO21molO2在一定条件反应:2SO2(g)+O2(g)?2SO3(g)△H<0.若:恒温恒容条件下SO2的转化率为a%;恒温恒压条件下SO2的转化率为b%;恒容绝热条件下SO2的转化率为c%;则它们之间的关系是:(选填:><=条件不够无法确定)
a%
查看习题详情和答案>>
a%
<
<
b% a%>
>
c% b%>
>
c%三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.可用如下流程来制备.
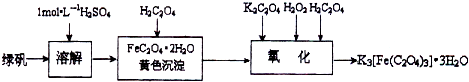
根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4?7H2O (填物质名称)往往要过量,理由是 .
(2)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO-4.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
回答43-46小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、 、转移、 、定容、摇匀.
(4)加入锌粉的目的是 .
(5)实验测得该晶体中铁的质量分数为 .在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”“偏高”“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
查看习题详情和答案>>

根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4?7H2O
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO-4.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
回答43-46小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)加入锌粉的目的是
(5)实验测得该晶体中铁的质量分数为
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式
三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]?3H2O)有很重要的用途.可用如下流程来制备.根据题意完成下列各题:
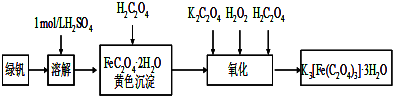
(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中 (填物质名称)往往要过量,理由是 .
(2)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀.
(4)步骤2中,加入锌粉的目的是 .
(5)步骤3中,发生反应的离子方程式为: .
(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”、“不变”)
查看习题详情和答案>>

(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)步骤2中,加入锌粉的目的是
(5)步骤3中,发生反应的离子方程式为:
(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量