网址:http://m.1010jiajiao.com/timu_id_4367293[举报]
(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1 ⅱ 2C(s)+ O2(g)
 2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1ⅲ C(s)+ O2(g)
 CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
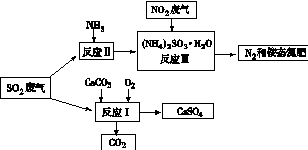
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。 查看习题详情和答案>>
(1)大气中氟氯烃的减少带来的积极效应是_________________________________________。
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质。
①若用NOx表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
![]()
②酸雨落至地面后pH在一定时间内变小然后稳定于某数值,原因是H2SO3受空气影响造成的,其化学方程式为_________________________________________。
(3)回收利用SO2既能减少大气污染,又能充分利用资源。已知:Fe2+、Fe3+作催化剂,标准状况下在转换器中SO2可被O2氧化成![]() ,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:
,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:

①在实验(Ⅰ)中,为了确定SO2的体积分数,可将模拟烟气缓慢通过已知体积和浓度的__________溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标准状况下)来计算SO2的体积分数。
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气体流速,还需测定的数据是__________和__________。
查看习题详情和答案>>世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、N、S氧化物的排放有增无减,水资源的紧缺和污染加剧.
(1)大气中氟氯烃的减少带来的积极效应是______.
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:______.
(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:

①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的______溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数.
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是______和______.
查看习题详情和答案>>
(1)大气中氟氯烃的减少带来的积极效应是
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:

②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:
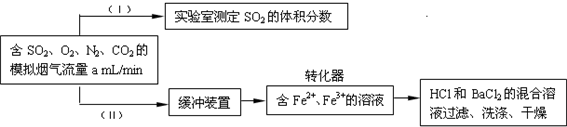
①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
(14分)阅读并完成以下各项内容:
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个化学反应的方程式:________________ , 。
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成 ________和NO。
③酸雨可导致的危害有________(填序号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.恶化人类环境
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮的氧化物用________吸收。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。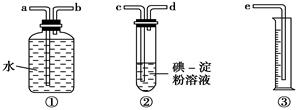
①若原料气从左向右流时,上述装置连接的顺序是:原料气→________ (用字母和箭头表示)。
②装置②中发生反应的离子方程式为: ;
当装置②中出现________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是________。
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水