题目内容
世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、S、N氧化物的排放有增无减,水资源的紧缺和污染加剧。(1)大气中氟氯烃的减少带来的积极效应是_________________________________________。
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质。
①若用NOx表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
![]()
②酸雨落至地面后pH在一定时间内变小然后稳定于某数值,原因是H2SO3受空气影响造成的,其化学方程式为_________________________________________。
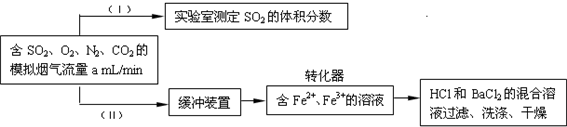
(3)回收利用SO2既能减少大气污染,又能充分利用资源。已知:Fe2+、Fe3+作催化剂,标准状况下在转换器中SO2可被O2氧化成![]() ,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:
,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:

①在实验(Ⅰ)中,为了确定SO2的体积分数,可将模拟烟气缓慢通过已知体积和浓度的__________溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标准状况下)来计算SO2的体积分数。
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气体流速,还需测定的数据是__________和__________。
(1)减缓臭氧空洞的增大(或其他合理答案)
(2)![]()
②2H2SO3+O2![]() 2H2SO4
2H2SO4
(3)①高锰酸钾(或碘水和淀粉的混合)
②实验时间 BaSO4的质量
解析:本题考查氧化还原反应的基本概念及其在生产、生活中的简单应用,属于容易题。第(2)问关键在于分析出N元素化合价的变化值为(5-2x),O2中O元素化合价的变化值共为4,这样两者的最小公倍数为4(5-2x),很容易配平;第(3)问中的①,只能利用SO2的还原性进行氧化还原滴定实验,如选择酸性高锰酸钾溶液或碘水和淀粉的混合溶液吸收SO2,这样,烟气中的O2、N2或CO2才没有干扰。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案