网址:http://m.1010jiajiao.com/timu_id_4367288[举报]
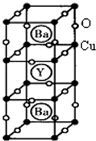
(12分) (物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品——紫色的硅酸铜钡。凑巧的是,后者正是发现于中汉代器物上的被称为“汉紫”的颜料,还发现于秦俑彩绘。 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
(1)给出铜在周期表中的位置(周期和族)
(2)写出基态Cu原子的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
(4)①某+1价铜的配离子为[Cu(CN)4]3-,与其配体互为等电子体的一种微粒是
(写化学式)。
②许多+1价铜的化合物的溶液能吸收CO和烯烃(如C2H4、CH3-CH=CH2……),CH3-CH=CH2分子中C原子的杂化方式是 、 。
(5)在硫酸铜溶液中逐滴加入氨水至过量,观察到先出现蓝色沉淀,最终沉淀溶解得到深蓝色的溶液。写出蓝色沉淀溶解的离子方程式 。
查看习题详情和答案>>①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素.
(1)A的名称是______,A原子的电子排布式为______;B位于周期表中第______周期______族;C的原子结构示意图是______.
(2)E的单质颜色是______.
(3)A元素与D元素形成化合物的电子式是______.
(4)G的单质与水反应的化学方程式是______.
(5)F的元素符号是______.
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是______,酸性最强的化学式是______,气态氢化物最稳定的化学式是______.
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:______.
查看习题详情和答案>>
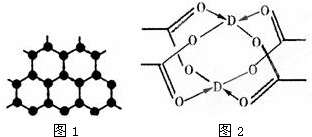 原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:(1)这四种元素中电负性最大的是
(2)C所在的主族元素气态氢化物中,沸点最低的是
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图1所示,其原子的杂化类型为
(4)D的水合醋酸盐晶体局部结构如图2,该晶体中含有的化学键是
①极性键 ②非极性键 ③配位键 ④金属键.
 (物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘.
(物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘.钇钡铜氧的晶胞结构如图.研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价.
(1)给出铜在周期表中的位置(周期和族)
(2)写出Cu3+的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
(4)根据(3)所推出的化合物的组成,计算出其中Cu原子的平均化合价(该化合物中各元素的化合价为Y3+、Ba2+),最后计算化合物中这两种价态Cu原子个数比为:
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是__________________、_____________________;杂化轨道分别是_________________、_________________;a分子的立体结构是_________________;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是______________晶体、_______________晶体;
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)_________________;
(4)Y与Z比较,电负性较大的是(填元素符号)_________________;
(5)W的元素符号是____________,其+2价离子的核外电子排布式是_________________。
查看习题详情和答案>>