网址:http://m.1010jiajiao.com/timu_id_4367270[举报]
(1)化学反应中的ΔH是以_______ 的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为____0(填“大于”.“小于”),该反应是 _____(填“放热”或“吸热”)反应。
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。
已知:298K时,
H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ/mol ΔH(H2)= 436 kJ/mol, ΔH(Cl2)= 247 kJ/mol。 则ΔH(HCl)= ________________。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH = -25 kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH = -47 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH = +19 kJ/mol
请写出CO还原FeO的热化学方程式_______________________。
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态).
(1)化学反应中的ΔH是以________的形式体现的.对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为________0(填“大于”.“小于”),该反应是________(填“放热”或“吸热”)反应.
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.
已知:298 K时,H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ·mol-1 ΔH(H2)=436 kJ·mol-1,ΔH(Cl2)=247 kJ·mol-1.则ΔH(HCl)=________.
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe( s)+3CO2(g) ΔH=-25 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式________.
已知热化学方程式(Q1、Q2均为正值):
C(s)+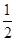 O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g)
ΔH=-Q2 kJ·mol-1,
O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g)
ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
A.Q1<Q2
B.生成物总能量均高于反应物总能量
C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量
D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量
查看习题详情和答案>>
已知热化学方程式2SO2(g)+ O2(g)  2 SO3(g) △H=-Q
kJ·mol-1(Q>0),则下列说法正确的是
2 SO3(g) △H=-Q
kJ·mol-1(Q>0),则下列说法正确的是
A.单位时间内生成2molSO2,同时生成1molO2,说明反应达到平衡状态
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,正反应速率增大,逆反应速率减小,上述热化学方程式中的Q值减小
D.上述热化学反应方程式说明反应物的总键能小于生成物的总键能
查看习题详情和答案>>
| |||||||||||||||