摘要:点评二: 化学:难度略高于去年 点评人 朱德尧 特级教师.学大教育化学任课老师 化学试题整体来说.所考查的知识点涵盖了中学化学所有的重点知识.试题难度与2008年试题难度大致相当.有些同学和老师认为今年高考试卷比去年难度大.也有其一定道理. 2009年是旧教材使用的最后一年.不但要对以旧教材为本的高考画上一个圆满的句号.还要在稳中求变.引领2010年新课标新教材的高考方向.指导2010年的高三化学复习.所以还要体现出“求新 .今年的高考试卷从题型和知识.能力考查的角度和知识综合程度.可以看出试卷的编纂者在力求试题新颖上.下了很大的工夫.可能有一些同学不能适应这样的考查方式和思路.就有可能感到今年的高考理综化学试题偏难.
网址:http://m.1010jiajiao.com/timu_id_4357366[举报]
(1)1811年法国化学家库特瓦用硫酸处理海藻灰时发现了碘.碘单质通常状况下为
(2)1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴.溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂.溴的原子序数为35,其原子结构简图为
 ;溴化钠中存在的化学键是
;溴化钠中存在的化学键是
 ,溴化钠的电离方程式为
,溴化钠的电离方程式为
查看习题详情和答案>>
紫黑
紫黑
色固体,其制剂可用来消毒和治疗甲状腺肿.碘缺乏病是目前已知的导致人类智力障碍的主要原因,因此碘元素称作“智慧元素”.碘的单质有两种特性,一是物理特性:易升华
易升华
;二是化学特性:遇淀粉显蓝色
遇淀粉显蓝色
.(2)1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴.溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂.溴的原子序数为35,其原子结构简图为


离子键
离子键
,在物理性质上表现出熔沸点较高、硬度较大
熔沸点较高、硬度较大
.氯化钠的电子式为

NaBr=Na++Br-
NaBr=Na++Br-
.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在
取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在
.下列共有十二种化学符号:
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧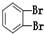 ⑨235U ⑩
⑨235U ⑩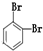
(11) (12)
(12)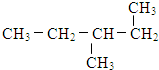
其中:
(1)表示核素的符号共有
(2)互为同位素的是
(3)质量数相等,但不能互称同位素的是
(4)中子数相等,但质子数不相等的是
(5)互为同素异形体的是
(6)互为同分异构体的是
查看习题详情和答案>>
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧
 ⑨235U ⑩
⑨235U ⑩
(11)
 (12)
(12)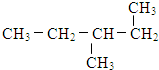
其中:
(1)表示核素的符号共有
6
6
种;(2)互为同位素的是
③⑨
③⑨
(填序号,以下相同);(3)质量数相等,但不能互称同位素的是
②⑥
②⑥
;(4)中子数相等,但质子数不相等的是
④⑦
④⑦
;(5)互为同素异形体的是
①⑤
①⑤
;(6)互为同分异构体的是
(11)(12)
(11)(12)
.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填”>”或”=”或”<”),原因是(用离子方程式表示): ,实验室在配制AgNO3的溶液时为了抑制其水解,常将AgNO3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度.
(2)把FeCl3溶液加热蒸干,灼烧,最后得到的主要固体产物是 ,原因是(用二个化学方程式来说明): ; .
查看习题详情和答案>>
(2)把FeCl3溶液加热蒸干,灼烧,最后得到的主要固体产物是
有A、B、C、D、E五种短周期元素,其元素特征信息如下表
回答下列问题:
(1)写出下列元素的名称:C ,E .
(2)写出A、B、C形成的化合物的电子式 .
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示) .
(4)①写出E单质与A、B、C形成的化合物反应的化学方程式: .
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式: .
③B、C元素形成的化合物与A2B反应的二个化学方程式: .
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C
(2)写出A、B、C形成的化合物的电子式
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)
(4)①写出E单质与A、B、C形成的化合物反应的化学方程式:
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:
③B、C元素形成的化合物与A2B反应的二个化学方程式:
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是 .
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
II.工业上制取高纯硅和四氯化硅的生产流程如下:

已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称) 。
(2)写出焦炭与原料B中的主要成分反应的化学方程式: 。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu (填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极: ;阴极: 。
查看习题详情和答案>>