网址:http://m.1010jiajiao.com/timu_id_4354310[举报]
| |||||||||||||||||||||||||||||||||||||||||
 硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气
硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气
中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.
请回答:
(1)加入过量的氯化钡溶液的目的是______.
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明______.
(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质.请说明应通过什么方法验证可溶物质是否已被除尽______ (选填“偏高”、“偏低”或“不受影响”).
(5)反应管内碘的淀粉溶液可以用下列______(填代号)代替.
A.NaOH溶液 B.酸性KMnO4溶液
C.Na2SO3溶液 D.BaCl2溶液
(6)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为该缺陷是______.
查看习题详情和答案>>
硫酸工厂周围的空气中有较多的二氧化硫。某研究性学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
请回答:
(1)加入过量的氯化钡溶液的目的是 。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明
。
(3)过滤后,一般要用蒸馏水洗涤沉淀2—3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)
。

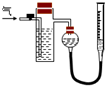
 方案二:如右图所示,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:如右图所示,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”、“偏低”或“不受影响”)。
(5)反应管内碘的淀粉溶液可以用下列 (填代号)代替。
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定
结果(不属于操作错误),你认为该缺陷是
。
查看习题详情和答案>>(16分)某兴趣小组为验证日常生活用的火柴头上只含有KClO3、MnO2、S,设计了以下实验流程图,请回答以下问题:
(1) 写出步骤①中可能发生一个反应的化学方程式 。
(2)为验证气体A,按下图所示进行实验:若能观察到 的现象,即可证明火柴头上含有S元素。
(3) 步骤②的实验操作装置如下图所示
a.该操作的名称是 。
b.写出图中A仪器的名称: __ ___;
c.该装置图有几处错误.
请指出
B仪器处关键性的错误:__________ C仪器处的错误改进后应是: 。
(4)要证明火柴头中含有Cl元素,
在步骤②以后的实验步骤是 。
(5)有学生提出检验火柴头上中含有Cl元素,另一套实验方案:
请写出有关的离子反应方程式为 ,
有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是 。
查看习题详情和答案>>
(16分)某兴趣小组为验证日常生活用的火柴头上只含有KClO3、MnO2、S,设计了以下实验流程图,请回答以下问题:
(1) 写出步骤①中可能发生一个反应的化学方程式 。
(2)为验证气体A,按下图所示进行实验:若能观察到 的现象,即可证明火柴头上含有S元素。
(3) 步骤②的实验操作装置如下图所示
a.该操作的名称是 。
b.写出图中A仪器的名称: __ ___;
c.该装置图有几处错误.
请指出
B仪器处关键性的错误:__________ C仪器处的错误改进后应是: 。
(4)要证明火柴头中含有Cl元素,
在步骤②以后的实验步骤是 。
(5)有学生提出检验火柴头上中含有Cl元素,另一套实验方案:
|
