摘要:特点:(1)是平均速率,均取正值;(2) 或 不适宜用来表示速率 (3)同一反应中用不同的物质表示的速率,其数值可能不同.但意义一样.
网址:http://m.1010jiajiao.com/timu_id_4347360[举报]
甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表:

(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出 、
、 与
与 之间的关系,
之间的关系, =______用
=______用 、
、 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻, 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)=
若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。

(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
A.容器中总压强不变
B.混台气体的平均摩尔质量也始终保持不变,
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将a mol/L醋酸溶液与bmol/LNaOH溶液等体积混合。若溶液显中性,则a_________b(选填“>”“<”“=”)。若c(Na+)<c(CH3COO-),则溶液显____性(选填“酸”“碱…中”)。
查看习题详情和答案>>
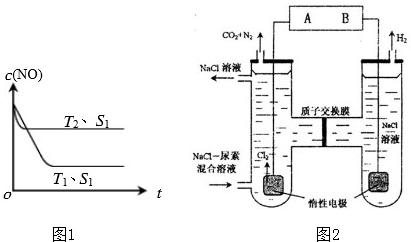 汽车尾气已成为重要的空气污染物.
汽车尾气已成为重要的空气污染物.(1)汽车内燃机工作时引起反应:N2(g)+O2(g)=2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO 物质的量为6mol,该反应的速率v(NO)为
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1是反应:
2NO(g)+2CO(g)=2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图2:
①电源的负极为
②阳极室中发生的反应为
③电解结束后,阴极室溶液的pH与电解前相比将
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气的转化率,则
| a |
| b |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正
(2006?南充一模)某中学“水情况监测与分析”化学兴趣小组测定某河流中氧的含量;经查阅有关资料了解到溶解氧测定可用“碘量法”,有关原理用如下方程式表示:
a.MnSO4+2NaOH═Mn(OH)2↓+Na2SO4
b. Mn(OH)2+
Mn(OH)2+ O2--H2MnO3
O2--H2MnO3
c.H2MnO3+Mn(OH)2═MnMnO3+2H2O
d.MnMnO3具有氧化性,在酸性条件下可与KI发生反应:
 MnMnO3+
MnMnO3+ H2SO4+
H2SO4+ KI---
KI--- MnSO4+
MnSO4+ I2+
I2+ H2O+
H2O+ K2SO4
K2SO4
(1)请配平b和d两方程式.b
(2)然后用
(3)在仪器准备中有容量瓶、量筒、移液管、锥形瓶、铁架台,为完成实验,还缺少的必要仪器是
(4)他们在三处取样,A处于河流上游的自来水厂取水口处,B处在距某有机物生产厂排污口不远处,C处在河流的下游.测得三个结果:4.60mg?L-1、8.09mg?L-1、8.19mg?L-1,请判断4.60mg?L-1是在
(5)取100mL水样,用n mol?L-1的Na2S2O3溶液进行滴定,当最后一滴Na2S2O3溶液滴入锥形瓶时,溶液颜色由
查看习题详情和答案>>
a.MnSO4+2NaOH═Mn(OH)2↓+Na2SO4
b.
 Mn(OH)2+
Mn(OH)2+ O2--H2MnO3
O2--H2MnO3c.H2MnO3+Mn(OH)2═MnMnO3+2H2O
d.MnMnO3具有氧化性,在酸性条件下可与KI发生反应:
 MnMnO3+
MnMnO3+ H2SO4+
H2SO4+ KI---
KI--- MnSO4+
MnSO4+ I2+
I2+ H2O+
H2O+ K2SO4
K2SO4(1)请配平b和d两方程式.b
2,1,2
2,1,2
d1,3,2,2,1,3,1
1,3,2,2,1,3,1
(填配平的计量数).(2)然后用
淀粉
淀粉
作指示剂,用硫代硫酸钠标准溶液滴定析出的碘(2Na2S2O3+I2═2NaI+Na2S4O6).根据上述物质间存在的关系,即可计算出溶解氧的量.(3)在仪器准备中有容量瓶、量筒、移液管、锥形瓶、铁架台,为完成实验,还缺少的必要仪器是
碱式滴定管
碱式滴定管
.(4)他们在三处取样,A处于河流上游的自来水厂取水口处,B处在距某有机物生产厂排污口不远处,C处在河流的下游.测得三个结果:4.60mg?L-1、8.09mg?L-1、8.19mg?L-1,请判断4.60mg?L-1是在
B
B
(填“A”、“B”或“C”)处水样中溶解氧的数据.(5)取100mL水样,用n mol?L-1的Na2S2O3溶液进行滴定,当最后一滴Na2S2O3溶液滴入锥形瓶时,溶液颜色由
蓝色
蓝色
变为无色
无色
,消耗V mL Na2S2O3溶液,则溶解氧的浓度为80Vn
80Vn
mg?L-1(用V、n表示).中国“十一五”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是 .
A.制备环氧乙烷:2CH2=CH2+O2
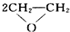
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 ,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 .
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
①从产率和产量角度分析 .
②从环境保护和能耗角度分析 .
查看习题详情和答案>>
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是
A.制备环氧乙烷:2CH2=CH2+O2
| 催化剂 |
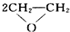
B.制备硫酸铜:Cu+2H2SO4
| ||
C.制备甲醇:2CH4+O2
| 催化剂 |
| 加热加压 |
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析
②从环境保护和能耗角度分析
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y、的单质是生活中常见的金属,相关物质间的关系如下图所示.

回答下列问题:
(1)X的单质与A反应的化学方程式是
(2)若C溶液显碱性,则试剂1是
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
②写出D-E反应的离子方程式
③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
查看习题详情和答案>>

回答下列问题:
(1)X的单质与A反应的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
.
| ||
(2)若C溶液显碱性,则试剂1是
NaOH(或KOH)
NaOH(或KOH)
溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;②写出D-E反应的离子方程式
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
;③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
.