��Ŀ����
�״�����Ҫ�Ļ���ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2�������״����״���
���������Ϣ���±���

��1����Ӧ����____��Ӧ��ѡ����ȡ������ȡ�����
��2�����ϱ���Ϣ�Ƶ��� ��
�� ��
�� ֮��Ĺ�ϵ��
֮��Ĺ�ϵ�� =______��
=______�� ��
�� ��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣�
��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣� ��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ
��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ ��ѡ�>����<����=������
��ѡ�>����<����=������
��3)��ij�¶��·�Ӧ�ٴӿ�ʼ��ƽ��CO��CH3OH��Ũ�ȱ仯��ͼһ��ʾ������H2Ũ�ȱ仯��ʾ�˶�ʱ���ڸ÷�Ӧ��ƽ����.v(H2)=
��ij�¶��·�Ӧ����H2��ƽ��ת����(a)����ϵ��ѹǿ(P)�Ĺ�ϵ��ͼ����ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ�� ��ѡ�>����<����=������
��ѡ�>����<����=������

��4��һ���¶��£�������̶����ܱ������з�����Ӧ�ڣ����жϸ÷�Ӧ�Ѿ��ﵽƽ�����____��������Ӧ��ĸ��ʾ��
A����������ѹǿ����
B����̨�����ƽ��Ħ������Ҳʼ�ձ��ֲ��䣬
C�����������ܶȲ���
D��CO2(g)��CO(g)��Ũ�Ȳ���
��5��һ�������¼״���һ����̼��Ӧ�ɺϳɴ��ᡣ�����£���a mol/L������Һ��bmol/LNaOH��Һ�������ϡ�����Һ�����ԣ���a_________b��ѡ�>����<����=��������c(Na��)<c(CH3COO��)������Һ��____�ԣ�ѡ��ᡱ����С�����
��1�� ���� (1��)
��2�� K1K2 (2��) > (2��)
��3�� 0.15mol/(L��min) (2��) = (2��)
��4�� D (1��) ��5��> (2��) �� (2��)
��������
�����������1����Ӧ�ڵ�K�����¶ȵ����߶����ʷ�Ӧ��Ϊ���ȷ�Ӧ��2����+��=�ۣ���K3=K1K2��500��ʱ��Ӧ����ijʱ�̵�Q=0.3��0.15�£�0.83��0.1��=0.88<2.5,ƽ�������ƶ�����V��>V������3��v��H2��=2v��CO��=2����1.00-0.25����10mol��L-1��min-1=0.15 mol��L-1��min-1��ƽ�ⳣ�����¶Ⱥ������¶Ȳ��䣬K���䣬��K(A)=K(B)��4����Ӧ����һ����Ӧǰ���������ķ�Ӧ����ѹǿ������Ϊ�ж��Ƿ�ƽ��ı�־����̨�����ƽ��Ħ������Ҳʼ�ձ��ֲ��䣬����������̶����ܱ������з�����Ӧ�ڣ����Ի��������ܶ�Ҳ���䣬��ѡD����5���������������Ƶ�����кͣ�����Һ�����ԣ�˵�������������a>b����c(Na��)<c(CH3COO��) ����c(H��)>c(OH��)����Һ������
���㣺���黯ѧƽ��

 ��������ϵ�д�
��������ϵ�д���1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g��+2H2��g��
 CH3OH��g����H1
CH3OH��g����H1��Ӧ��CO2��g��+3H2��g��
 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2���������Ʊ��״���������Ӧ�У���ӦI���ڷ�ӦII��ԭ��Ϊ______��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ������ֵ��
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
II��ij�¶��£���1mol CO��4molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ����c��CO��=0.1mol/L����CO��ת����Ϊ______����ʱ���¶�______250�棨�����������������=����
��2����֪�ڳ��³�ѹ�£���2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l����H1=-Q1kJ/mol
��2CO ��g��+O2��g��=2CO2��g����H2=-Q2 kJ/mol��H2O��g��=H2O��l����H3=-Q3 kJ/mol
��д���״���������ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ��Ӧ����ʽ��______
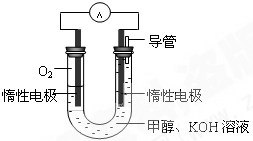
��3��ijͬѧ���ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�����һ��ʱ������Һ��pH��______����ߡ��������͡��������䡱������ȼ�ϵ�ظ�����Ӧ�����ӷ���ʽΪ��______��

 �״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã�
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã� CH3OH��g����H1
CH3OH��g����H1 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2 CH3OH��g��
CH3OH��g��

 CH3OH(g) ��H1
CH3OH(g) ��H1  CH3OH(g)+H2O(g) ��H2
CH3OH(g)+H2O(g) ��H2 
