摘要:(一)含义:0.012kg12C中所含有碳原子数为阿伏加德罗常数.根据实验测得其数值约为6.02×1023.
网址:http://m.1010jiajiao.com/timu_id_4341971[举报]
现有两瓶硫酸溶液,其中一瓶的物质的量浓度为1 mol·L-1,另一瓶为0.01 mol·L-1,用以下试剂:①紫色石蕊试液?
②甲基橙试液 ③蒸馏水 ④pH试纸 ⑤BaCl2溶液?⑥0.1 mol·?L-1 Na2S2O3溶液,试用两种简便方法将这两种不同浓度的硫酸溶液区分开: 。?
查看习题详情和答案>>乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂。EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y-=(MY)2-;M3++Y4-=(MY)-。两反应的平衡常数分别记作K[(MY)2-] 和K[(MY)-] 已知:Zn2+遇二甲酚橙显红色,且Zn(CH3COO)2易电离试根据上述信息,回答下列问题。
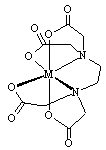
(1)(MY)x-的结构简式如下图,该离子中与金属离子相连接的有6个共价键,则该离子结构中共含有____个五元环。
(2)现称取某铝盐试样0.2500g,将其溶于水后加入0.05000 mol/L EDTA溶液25.00mL,在适当条件下充分反应后,调节溶液的pH为5~6,加入指示剂二甲酚橙,再用0.02000 mol/L的Zn(CH3COO)2溶液25.00mL 滴定至终点,
问:达到终点的标志是_________________________;求该试样中铝元素的质量分数______________。
(3)有一起始含0.01 mol/L的M2+、0.5 mol/LEDTA(Y4-)和0.001 mol/L的S2-的溶液,判断在该溶液中能否产生金属硫化物(MS)沉淀。
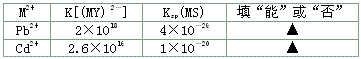
(1)(MY)x-的结构简式如下图,该离子中与金属离子相连接的有6个共价键,则该离子结构中共含有____个五元环。
(2)现称取某铝盐试样0.2500g,将其溶于水后加入0.05000 mol/L EDTA溶液25.00mL,在适当条件下充分反应后,调节溶液的pH为5~6,加入指示剂二甲酚橙,再用0.02000 mol/L的Zn(CH3COO)2溶液25.00mL 滴定至终点,
问:达到终点的标志是_________________________;求该试样中铝元素的质量分数______________。
(3)有一起始含0.01 mol/L的M2+、0.5 mol/LEDTA(Y4-)和0.001 mol/L的S2-的溶液,判断在该溶液中能否产生金属硫化物(MS)沉淀。
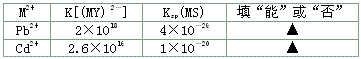
乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂。EDTA的阴离子可简写为
Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2+ + Y4-=(MY)2-;M3+ + Y4-=(MY)-。两反应的平衡常数分别记作K[(MY)2-] 和K[(MY)-]
已知:Zn2+遇二甲酚橙显红色,且Zn(CH3COO)2易电离试根据上述信息,回答下列问题。
(1)(MY)x-的结构简式如图,该离子中与金属离子相连接的有6 个共价键,则该离子结构中共含有
______个五元环。
Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2+ + Y4-=(MY)2-;M3+ + Y4-=(MY)-。两反应的平衡常数分别记作K[(MY)2-] 和K[(MY)-]
已知:Zn2+遇二甲酚橙显红色,且Zn(CH3COO)2易电离试根据上述信息,回答下列问题。
(1)(MY)x-的结构简式如图,该离子中与金属离子相连接的有6 个共价键,则该离子结构中共含有
______个五元环。

(2)现称取某铝盐试样0.2500g,将其溶于水后加入0.05000 mol·L-1 EDTA溶液25.00mL,在适当条件下充分反应后,调节溶液的pH 为5~6,加入指示剂二甲酚橙,再用0.02000 mol·L-1的Zn(CH3COO)2溶液
25.00mL 滴定至终点,问:达到终点的标志是____________;求该试样中铝元素的质量分数______。
(3)有一起始含0.01 mol·L-1的M2+、0.5 mol·L-1 EDTA(Y4-)和0.001 mol·L-1的S2-的溶液,判断在该溶液中能否产生金属硫化物(MS)沉淀。
25.00mL 滴定至终点,问:达到终点的标志是____________;求该试样中铝元素的质量分数______。
(3)有一起始含0.01 mol·L-1的M2+、0.5 mol·L-1 EDTA(Y4-)和0.001 mol·L-1的S2-的溶液,判断在该溶液中能否产生金属硫化物(MS)沉淀。

 (2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
(2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.(1)合成二甲醚反应一:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=-247kJ/mol一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
AE
AE
.A.低温高压 B.加催化剂 C.体积不变充入N2 D.增加CO浓度 E.分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)═CH3OCH3(g)+H2O(g).在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物 质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |
400
400
.②10min内平均反应速率v(CH3OH)=
0.04mol?L-1?min-1
0.04mol?L-1?min-1
;(3)如图为绿色电源“二甲醚燃料电池”的工作原理示意图.该反应的还原剂是
二甲醚
二甲醚
(写名称);若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:
(CH3)2O-12e-+3H2O=2CO2+12H+或C2H6O-12e-+3H2O=2CO2+12H+
(CH3)2O-12e-+3H2O=2CO2+12H+或C2H6O-12e-+3H2O=2CO2+12H+
.下列图示与对应叙述相符合的是( )


| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | B、图2表示Cl2通入SO2溶液中pH的变化 | C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | D、图4表示已达平衡的某可逆反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |