摘要: A. brave B. hard C. smart D. unfair
网址:http://m.1010jiajiao.com/timu_id_4339092[举报]
废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4?7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
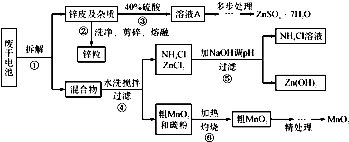
(1)操作②中所用的加热仪器应选
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
由上表数据分析应调节溶液pH最好为
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
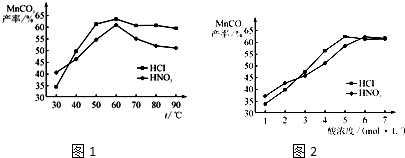
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
查看习题详情和答案>>

(1)操作②中所用的加热仪器应选
坩埚
坩埚
(填“蒸发皿”或“坩埚”).(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
.(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
a
a
(填字母).a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
.步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
.步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
2MnCO3+O2
2MnO2+2CO2
| ||
2MnCO3+O2
2MnO2+2CO2
.
| ||
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
60
60
℃左右.②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
6
6
mol?L-1左右.
去下列各粉末状混合物中的杂质(括号内物质为杂质),请按下列提供的试剂和操作,将序号填在表内.
试剂:A盐酸 B烧碱溶液 C氧气 D水 E二氧化碳 F不需要其他试剂
操作:①加热 ②加热熔融 ③过滤 ④蒸馏⑤结晶
查看习题详情和答案>>
试剂:A盐酸 B烧碱溶液 C氧气 D水 E二氧化碳 F不需要其他试剂
操作:①加热 ②加热熔融 ③过滤 ④蒸馏⑤结晶
| 混合物 | 试剂 | 操作 | ①NaCl(SiO2) | ②Mg(Al) | ③Fe2O3(SiO2) |
 如图所示,从A处通入气体a,若关闭B阀门时,C处有色布条没有明显变化,打开B阀门时,C处有色布条逐渐褪色,则气体a( )
如图所示,从A处通入气体a,若关闭B阀门时,C处有色布条没有明显变化,打开B阀门时,C处有色布条逐渐褪色,则气体a( )| A、肯定是Cl2 | B、肯定是SO2 | C、可能是Cl2和SO2的混合气体 | D、可能是Cl2,也可能是SO2 |
甲学生急需3.0mol?L-1 稀硫酸做探究性实验,而此时实验室只有18.4mol?L-1 浓硫酸.请你为他配制100mL 3.0mol?L-1 稀硫酸.
(1)建议配制过程如下:
1.计算所需浓硫酸的体积是
2.稀释.具体操作过程是
3.待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入
4.将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用
5.将配好的溶液转移到试剂瓶中,交甲同学使用.
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?
(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
C.所用过的烧杯、玻璃棒未洗涤
查看习题详情和答案>>
(1)建议配制过程如下:
1.计算所需浓硫酸的体积是
16.3
16.3
mL,量取浓硫酸所用的量筒的规格是B
B
(从下列中选用A.10mL B.25mL C.50mL D.100mL).2.稀释.具体操作过程是
沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌
沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌
.3.待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入
100mL容量瓶
100mL容量瓶
.用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入其中.轻轻摇动容量瓶,使溶液混合均匀.4.将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用
胶头滴管
胶头滴管
加水至液面与刻度线相切.盖好瓶塞,反复上下颠倒、摇匀.5.将配好的溶液转移到试剂瓶中,交甲同学使用.
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?
(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
偏低
偏低
B.容量瓶用蒸馏水洗涤后残留有少量的水不影响
不影响
C.所用过的烧杯、玻璃棒未洗涤
偏低
偏低
?D.定容时俯视刻度线偏高
偏高
?