网址:http://m.1010jiajiao.com/timu_id_4338970[举报]
下表是某铬酸(H2CrO4)溶液中离子浓度(mol?L-1)与pH的关系,下列说法中不正确的是( )
|

回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
(2)设备B中m和n是两个通水口,入水口是
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28109 | 38109 | 48109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
| ||
| 催化剂 |
| ||
| 催化剂 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
| ||
| ||
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |
(1)用如图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
(10分)下表是某城市某日的空气质量报告:
|
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
|
55 |
SO2 |
II |
良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
[探究实验一]用下图所示装置进行实验。
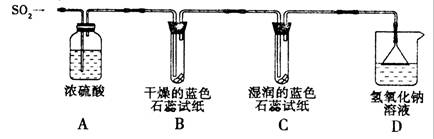
① A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸。
③ D装置的作用是 ,D中发生反应的化学方程式是 。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为 m3。
查看习题详情和答案>>
催化剂 | KClO3/g | 催化剂/g | 反应结束时间/s | 反应现象 |
MnO2 | 0.5 | 0.1 | 47 | 红热现象 |
Fe2O3 | 0.5 | 0.1 | 57 | 稳定 |
Cr2O3 | 0.5 | 0.1 | 67 | 由绿变黄 |
Al2O3 | 0.5 | 0.1 | 84 | 较慢 |
SiO2 | 0.5 | 0.1 | 181 | 缓慢 |
(注:红热现象指反应中有红色火光,反应剧烈并在短时间内结束)
(1)请你为这个实验拟定实验目的。
(2)你认为催化效果最好的是哪种,催化效果不好的是哪种?
(3)若要研究“催化剂的用量对催化效果的影响(用产生氧气的体积表示)”,请你设计实验的记录数据。