网址:http://m.1010jiajiao.com/timu_id_4069992[举报]
Ⅰ.
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为
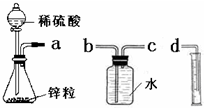 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.(1)为达到本实验目的其装置连接顺序为:
a连
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
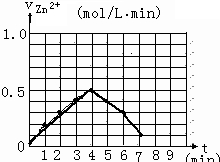
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:
 查看习题详情和答案>>
查看习题详情和答案>>
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响。

(1)为达到本实验目的其装置连接顺序为:a连________,________连________.
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
|
加入的试剂 |
H2的体积(相同条件下) |
反应时间 |
反应速率 |
|
1mol/L硫酸酸 |
10mL |
t1 |
v1 |
|
4mol/L硫酸 |
10mL |
t2 |
v2 |
该小组同学通过实验得到的结果是:v1 小于 v2,其定量依据是_______________________.
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:

请在给定的坐标图中作出v(H2)-t的图像.

请解释0到4mim时该化学反应速率随时间变化的原因: .
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: (任写一种).
查看习题详情和答案>>
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响。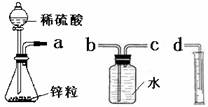
(1)为达到本实验目的其装置连接顺序为:a连________,________连________.
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:

请在给定的坐标图中作出v(H2)-t的图像.
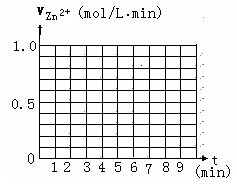
请解释0到4mim时该化学反应速率随时间变化的原因: .
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: (任写一种). 查看习题详情和答案>>
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
(1)按A、B、C顺序,三种元素的金属性逐渐
(2)一定条件下,将4.0mol FE2和3.0mol E2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
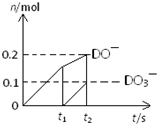
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为