题目内容
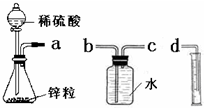 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.(1)为达到本实验目的其装置连接顺序为:
a连
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
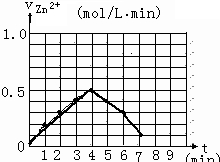
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:
分析:(1)图示装置按照发生装置、排水法测量气体体积的顺序进行连接;
(2)连接后装置后,在装入药品前必须检查装置的气密性是否良好,避免影响测定结果;
(3)锥形瓶中锌与稀硫酸反应生成硫酸锌和氢气,据此写出反应的离子方程式;
(4)根据浓度对反应速率的影响进行判断t1、t2的大小关系;
(5)根据表中不同时间段稀硫酸的浓度可以画出v(H2)-t的图象;根据该反应为放热反应及温度对反应速率的影响进行判断;
(6)还可以通过测定相同时间内生成氢气的体积来判断浓度对反应速率的影响.
(2)连接后装置后,在装入药品前必须检查装置的气密性是否良好,避免影响测定结果;
(3)锥形瓶中锌与稀硫酸反应生成硫酸锌和氢气,据此写出反应的离子方程式;
(4)根据浓度对反应速率的影响进行判断t1、t2的大小关系;
(5)根据表中不同时间段稀硫酸的浓度可以画出v(H2)-t的图象;根据该反应为放热反应及温度对反应速率的影响进行判断;
(6)还可以通过测定相同时间内生成氢气的体积来判断浓度对反应速率的影响.
解答:解:(1)根据图示装置可知,实验目的是通过排水法测定生成氢气体积,其中集气瓶中的导管应该为短进长出法,所以导管连接顺序为:a→c→b→d,
故答案为:cbd;
(2)先连接装置,在装入药品前需要检查装置的气密性,否则若气密性较差会影响测定结果,
故答案为:检查装置的气密性;
(3)锥形瓶中稀硫酸与金属锌发生反应生成氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(4)其它条件相同时,稀硫酸的浓度越大,反应速率越快,收集相同体积的氢气需要的时间越短,所以t1>t2,
故答案为:t1>t2;
(5)由表中时间与稀硫酸的浓度关系可以画出v(H2)-t的图象为: ;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
故答案为: ;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可以通过测定相同时间内测定生成H2的体积进行判断浓度对反应速率的影响,
故答案为:相同时间内测定生成H2的体积(或相同时间内测定Zn的质量)(其他合理答案均可).
故答案为:cbd;
(2)先连接装置,在装入药品前需要检查装置的气密性,否则若气密性较差会影响测定结果,
故答案为:检查装置的气密性;
(3)锥形瓶中稀硫酸与金属锌发生反应生成氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(4)其它条件相同时,稀硫酸的浓度越大,反应速率越快,收集相同体积的氢气需要的时间越短,所以t1>t2,
故答案为:t1>t2;
(5)由表中时间与稀硫酸的浓度关系可以画出v(H2)-t的图象为:
 ;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,故答案为:
 ;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;(6)除上述实验方案可定量测定该反应的化学反应速率外,还可以通过测定相同时间内测定生成H2的体积进行判断浓度对反应速率的影响,
故答案为:相同时间内测定生成H2的体积(或相同时间内测定Zn的质量)(其他合理答案均可).
点评:本题考查了探究浓度对反应速率的影响的方法,题目难度中等,注意明确难度对化学反应速率的影响,要求学生能够合理设计出探究浓度对反应速率影响的实验方案,并能够对实验方案的合理性进行正确评价.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目