网址:http://m.1010jiajiao.com/timu_id_4048999[举报]
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3﹣ |
Cl﹣ |
|
浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。
查看习题详情和答案>>
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g)  H>0
H>0汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。 查看习题详情和答案>>
| 物质 | Al | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ---- |
(1)铝热反应是氧化还原反应,在反应中金属铝表现出
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是
②该同学的实验方案是否合理?答:
(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol?L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mol?L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和
②n的取值范围是
③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为
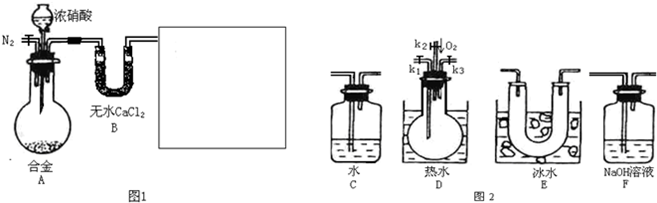
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)如果O2过量,则装置F中发生反应的化学方程式为:
(5)反应结束后,关闭开关将烧瓶拿出后的现象为
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
| a |
| 4 |
| a |
| 2 |
| a |
| 4 |
| a |
| 2 |

A、C、F中盛装澄清石灰水,B中盛NaOH溶液,E中装有CuO.请填写下列空白:
(1)证明产物中有CO2的现象是
(2)导管G的作用是
(3)小李同学查阅相关资料发现:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物.小李通过进一步研究认为:草酸蒸气与石灰水反应生成草酸钙白色沉淀,对实验有干扰,因此需要在装置A之前增加一个装有
a.水 b.NaOH溶液 c.Na2CO3溶液 d.饱和NaHCO3溶液
(4)如果在E管中盛装CuO和Cu2O的混合物,根据F瓶增重可以测定混合物中CuO的质量.当CuO和Cu2O的混合物7.6 g全部被还原后,F装置增重3.3 g,混合物中CuO的质量为
| 11a |
| 36 |
| 11a |
| 20 |
| 11a |
| 36 |
| 11a |
| 20 |