网址:http://m.1010jiajiao.com/timu_id_4040867[举报]
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 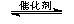 4NO(g)+CO2(g)+2H2O(g)?? △H1<0
4NO(g)+CO2(g)+2H2O(g)?? △H1<0
②CH4(g)+4NO(g) 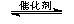 2N2(g)+CO2(g)+2H2O(g)???? △H2<0
2N2(g)+CO2(g)+2H2O(g)???? △H2<0
③CH4(g) +2NO2(g) 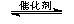 N2(g) +CO2(g) +2H2O(g)? △H3=????????? 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g)? △H3=????????? 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
1 | 60% | 43% | 28% |
2 | 45% | 33% | 20% |
①写出该反应平衡常数的表达式K=????????? 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将????????? 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数???????? 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
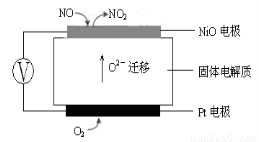

图1???????????????????????????????????? 图2
①NiO电极上NO发生的电极反应式:???????????????????????????????? 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=???
(4)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是????????????????????????????????????????????????????
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂???? B.降低温度???? C.分离出H2O(g)?????? D.增大压强
E.增加原催化剂的表面积?? F.减小投料比[n(NO2) / n(CH4)]
查看习题详情和答案>>
(15分)
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。
Ⅰ.MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH为下表所示。

(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2
的物质的量之比应为 。
(2)步骤二中b的值为 。
(3)步骤三中洗涤干净的标准是 。
Ⅱ.用MnFe2O4热化学循环制氢:
MnFe2O4(s)→MnFe2O(4-x)(s) + ![]() O2(g);△H1
O2(g);△H1
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
请回答下列问题:
(4) 若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为 。
(5)该热化学循环制氢的优点有 (填序号)。
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
则:△H3与△H1、△H2的关系为△H3= 。
查看习题详情和答案>>
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)? △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)??? △H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g)????? △H3=-867kJ·mol-1
则△H2=???????????????? 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为??? C(s) + H2O(g)= CO(g) + H2(g),
该反应的化学平衡常数表达式为K=???????????????????? 。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将????? 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是??????? (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将????? 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是??????? (填符号)。
a加入催化剂 ???? b降低温度?? ? c缩小容器体积 ???? d减少CO2的量

(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应???????????????????????? 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是??????????????? 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:

通入a气体的电极是原电池的? ??? (填“正”或“负”),
其电极反应式为? ??? ???? ????? 。
查看习题详情和答案>>
前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等。
(1)有机颗粒物的产生主要是由于不完全燃烧导致的相关热化学方程式如下:
①C(s)+O2(g)=CO2(g) ΔH1=-94kJ·mol-1;
②C8H16(l)+12O2(g)=8CO2(g)+8H2O(l)? ΔH2=-1124kJ·mol-1
③C8H16(l)+4O2=8C(g)+8H2O(l)ΔH3=????????????????? kJ·mol-1
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是:????????????? ????????????? ????????????? ????????????? ;通过质谱仪发现还有多种副反物,其中之一为: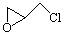 ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(3)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(4)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
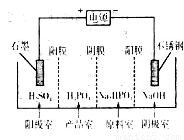
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看习题详情和答案>>
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ? ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
查看习题详情和答案>>