摘要:从下列事实所得出的相应结论正确的是( ) 实 验 事 实 结 论 ① Cl2的水溶液可以导电 Cl2是电解质 ② 将燃烧的镁条放入CO2中能继续燃烧 还原性:Mg>C ③ NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 酸性:HCO3->Al(OH)3 ④ 常温下白磷可自燃而氮气须在放电时才与氧气反应 非金属性:P>N ⑤ 某无色溶液中加入氢氧化钠溶液并加热.产生的气体能使湿润红色石蕊试纸变蓝 该溶液一定有NH4+ A.③④⑤ B.②③⑤ C.①②③ D.全部 [解析]选B.电解质必须是化合物①错误,氮气与氧气难以反应是因为氮气含有三键.非金属性:N>P.④错误.
网址:http://m.1010jiajiao.com/timu_id_4025028[举报]
(2010?安庆模拟)用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是( )
|
查看习题详情和答案>>
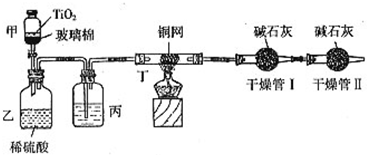 (2010?陕西模拟)根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.
(2010?陕西模拟)根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.该实验是通过测定CO2的量来确定对CN-的处理效果.回答下列问题:
(1)根据题意写出乙中反应的离子方程式
2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O
2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O
(2)丙装置中的试剂是
浓硫酸
浓硫酸
(填名称);丁装置的目的是除去Cl2
除去Cl2
.干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干燥管Ⅰ,干扰实验
防止空气中的CO2、水蒸气进入干燥管Ⅰ,干扰实验
.(3)假定上述每一个装置都充分吸收,则利用该装置计算得出的CN-被处理的百分率与实际值相比
偏低
偏低
(填:“偏高”或“偏低”),简述可能的原因:装置中残留有CO2未被完全吸收
装置中残留有CO2未被完全吸收
.(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中计算得出CN-被处理的百分率为
80%
80%
.