网址:http://m.1010jiajiao.com/timu_id_4024752[举报]
(1)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
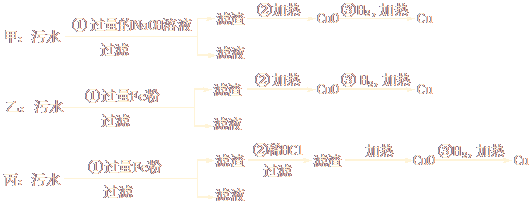
①甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲________________,乙_____________,丙________________。(填“能”或“不能”)
②在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染?__________________________。
(2)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合利用:

请回答下列问题:
①在图中的括号内填写适当的反应条件。
②Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
③依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得29.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
查看习题详情和答案>>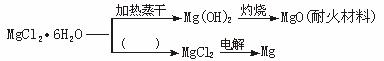
请回答下列问题:
(1)在图中的括号内填写适当的反应条件。
(2)Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
(3)NaF和MgO的核间距离分别为2.31×10-10 m和2.10×10-10 m,但两者的熔点分别为993 ℃和2852 ℃。试解释其可能的原因。
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得28.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
查看习题详情和答案>>
(1)在上图的括号内应填的是在_______________环境中加热。
(2)Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)
 Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________有利于Mg(OH)2溶解。(3)已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,某温度时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203kgMgCl2·6H2O原料可以获得29.8kg MgO、___________kg36.5%的盐酸和___________kg MgCl2。
| |||||||||||||||
已知 晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或MgO.下列是关于
晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或MgO.下列是关于 的综合应用:
的综合应用:

(1)在上图中的括号内填写适当的反应条件.
(2)NaF和MgO的核间距离分别为 ,但两者的熔点分别为993℃、2800℃.试解释其可能的原因_________________.
,但两者的熔点分别为993℃、2800℃.试解释其可能的原因_________________.
(3)工业上通过电解溶融 的方法制取单质Mg,为什么不用电解MgO方法生产单质Mg?
的方法制取单质Mg,为什么不用电解MgO方法生产单质Mg?
_____________________________________________________________.
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203kg 原料可以获得29.8kgMgO、________kg36.5%的盐酸和______kg
原料可以获得29.8kgMgO、________kg36.5%的盐酸和______kg .
.
