网址:http://m.1010jiajiao.com/timu_id_4023420[举报]
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t2时改变的条件是
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | Q1 | X1 | ||
| 乙 | 1 | 0.5 | Q2=39.4 | X2 | ||
| 丙 | 1 | 0.5 | 1 | Q3 | X3 | |
| 丁 | 1.8 | 0.9 | 0.2 | Q4 | X4 | |
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)______(填“增大”或“减小”),O2的浓度______(填“增大”或“减小”)
②假设又向容器中加入一定量的SO3(g),X(SO2)______ (填“增大”或“减小”)
(3)平衡时,乙容器中SO2的体积分数为______%(保留两位有效数字),该反应的平衡常数为______(填具体值和单位,保留两位有效数字)
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t 2时改变的条件是______;
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看习题详情和答案>>
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析:
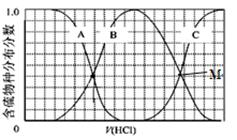
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。 查看习题详情和答案>>
(1)若平均每分钟生成0.5 mol C,容器表面向外散热速率平均为400 J·min-1·cm-2,为了维持恒温t ℃,平均每分钟需用加热器提供____________ kJ的热量。
(2)将2 mol A与1 mol B充入上述

①20 min时发生变化的条件是______________;
A.加入催化剂 B.降低温度
C.缩小了容器体积 D.增加了B物质的量
②在15 min达到平衡,此时平衡常数K=______________ (用分数表示)。若保持体系温度为t ℃,则随着反应的进行,K值____________。(填“增大”、“减小”或“不变”)
③若起始时在此
(本题共8分)将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g) CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
(1).用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是_____________________。
(2).当改变反应的某一个条件,平衡一定向正反应方向移动的是__________。
a.逆反应速率先增大后减少 b.正反应速率先增大后减少
c.某反应物的体积百分含量减小 d.化学平衡常数K值增大
(3).达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)。
| A.P3>P2T3>T2 | B.P2>P4T4>T2 |
| C.P1>P3T1>T3 | D.P1>P4T2>T3 |