网址:http://m.1010jiajiao.com/timu_id_4009974[举报]
(2009·安徽理综)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第______族。W的气态氢化物稳定性比H2O(g)_____(填“强”或“弱”)。
(2)Y基态原子核外电子排布式是________,Y第一电离能比X的___ (填“大”或“小)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:Fe(s)+ (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+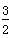 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是_________________________________________。
(2009·安徽理综)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第______族。W的气态氢化物稳定性比H2O(g)_____(填“强”或“弱”)。
(2)Y基态原子核外电子排布式是________,Y第一电离能比X的___ (填“大”或“小)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:Fe(s)+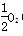 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+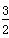 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是_________________________________________。
查看习题详情和答案>>
[s1] (2009年高考安徽卷)在溶液中能大量共存的一组离子或分子是 ( )
A.NH4+、H+、NO3-、HCO3-
B.K+、Al3+、SO42-、NH3·H2O
C.Na+、K+、SO32-、Cl2
D.Na+、CH3COO-、CO32-、OH-
[s1]4.
查看习题详情和答案>>[s1] (2009年高考安徽卷)在溶液中能大量共存的一组离子或分子是 ( )
A.NH4+、H+、NO3-、HCO3-
B.K+、Al3+、SO42-、NH3·H2O
C.Na+、K+、SO32-、Cl2
D.Na+、CH3COO-、CO32-、OH-
[s1]4.
查看习题详情和答案>>[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol.L-1 | |
| H2O | Fe2- | ||||
| (1) | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| (2) | 探究温度对降解反应速的影响率 | ||||
| (3) | 298 | 10 | 6.0 | 0.30 | |

(2)请根据如图实验①曲线,计算降解反应在50~150s内的反应速率:(p-CP)=
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
(4)实验③得出的结论是:
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法: