网址:http://m.1010jiajiao.com/timu_id_4009968[举报]

(1)实验室制取氨气的化学方程式为 ,工业上合成氨采取的下列措施中可用勒夏特列原理解释的是? ?(填字母)?
A.采用较高压强(20 Mpa~50 Mpa)?
B.采用500 ℃的高温?
C.用铁触媒作催化剂?
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2?
(2)适当改变如图所示的装置后,也可用来制取和收集氧气。改变的方法是: 。?
(3)实验室用浓硫酸和铜制取并收集少量的SO2气体,能否采用该装置 ? ?(填“能”或“不能”),若选填“能”,请说明理由;若选填“不能”,则怎样改变该装置后就能达到实验目的?请用文字说明 ;?
(4)取6.4 g铜片和12 mL 18.4 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,某同学根据所学的化学知识认为还有一定量的硫酸剩余。下列药品能够用来证明反应结束后烧瓶中确实有余酸的是?? ??(填字母)。?
A.铁粉 B.氯化钡溶液? C.银粉 D.碳酸氢钠溶液?
(5)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的
是 (填字母)?
A.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量?
B.将装置中产生的气体缓缓通入足量氢氧化钡溶液,反应完全后过滤、洗涤、干操、称量沉淀?
C.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后过滤、洗涤、干燥、称量沉淀?
请对不可行的方案进行分析(可以不填满)
方案序号 | 分析 | 误差(偏高或偏低) |
|
|
|
|
|
|
|
|
|
(6)请再设计其他可行的实验方案来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。??
查看习题详情和答案>>
(2)当加入35mL盐酸时,产生二氧化碳的体积为___________mL (标准状况)。
(3)原混合物中Na2CO3的质量分数为____________。
(二)氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)2NH3(g) ;△H = - 92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
(4)下列方法不适合实验室制取氨气的是____(填序号)。
A.向生石灰中滴加浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴加浓氢氧化钠溶液
(5)合成氨工业中采取的下列措施可用勒夏特列原理解释的是__________(填序号)。
A.采用较高压强(20 MPa~50 MPa) B.采用500℃的高温
C.用铁触媒作催化剂 D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(6)用数字化信息系统DIS(如下图I所示:它由传感器、数据 采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.500 0mol/L醋酸溶液25.00 mL于烧杯中,用该氨水进行滴定,计算机屏幕上显示出溶液的导电能力随氨水体积变化的曲线如图Ⅱ所示。

②试计算该氨水的浓度:__________________。
③下列情况下,会导致实验结果c(NH3·H2O)偏低的是________________。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,不慎将氨水滴在烧杯外
(7)1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。

| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能/KJ?mol | 360 | 436 | 431 | 176 |
SiCl4(g)+2H2(g)═Si(s)+4HCl(g),该反应的反应热△H为多少?
(1)此时在导线上有
(2)Zn片溶解的质量是
(3)原稀H2SO4的物质的量浓度是
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC
(2)能不能根据键能的数据判断单质Si和化合物SiCl4的熔点高低?
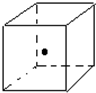
(3)如图立方体中心的“?”表示金刚石晶体中的一个原子,请在立方体的顶点用“?”表示出与之紧邻的碳原子

(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| 高温 |