题目内容
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC
>
>
Si; SiCl4<
<
SiO2(2)能不能根据键能的数据判断单质Si和化合物SiCl4的熔点高低?
不能
不能
(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低.
物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低.
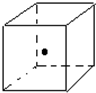
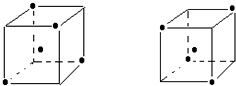
(3)如图立方体中心的“?”表示金刚石晶体中的一个原子,请在立方体的顶点用“?”表示出与之紧邻的碳原子

(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| 高温 |
+236kJ/mol
+236kJ/mol
.分析:(1)物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体的熔点;如果晶体类型相同,物质的熔点与化学键的键长成反比,键长越短,键能越大,熔点越高.
(2)晶体熔点与晶体类型有关,原子晶体中的作用力是共价键,分子晶体中的作用力是范德华力,共价键比范德华力大很多,导致异响其熔点.
(3)金刚石中每个碳原子和四个碳原子形成四个共价键,如果一个碳原子在正方体体心上,4个碳原子在相对的4个顶点上.
(4)化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和.
(2)晶体熔点与晶体类型有关,原子晶体中的作用力是共价键,分子晶体中的作用力是范德华力,共价键比范德华力大很多,导致异响其熔点.
(3)金刚石中每个碳原子和四个碳原子形成四个共价键,如果一个碳原子在正方体体心上,4个碳原子在相对的4个顶点上.
(4)化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和.
解答:解:(1)碳化硅和硅都是原子晶体,晶体类型相同的物质其熔点与键长成正比,键长越长,键能越小,熔点越低,碳化硅的键长小于硅硅键长,所以碳化硅的熔点比硅的高;二氧化硅是原子晶体,氯化硅是分子晶体,原子晶体的熔点高于分子晶体,所以二氧化硅的熔点比氯化硅的高.
故答案为:>,<.
(2)物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低.
故答案为:不能;物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低.
(3)金刚石中每个碳原子和四个碳原子形成四个共价键,如果一个碳原子在正方体体心上,4个碳原子在相对的4个顶点上,所以为: .
.
故答案为: .
.
(4)△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol.
故答案为:+236 kJ/mol.
故答案为:>,<.
(2)物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低.
故答案为:不能;物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低.
(3)金刚石中每个碳原子和四个碳原子形成四个共价键,如果一个碳原子在正方体体心上,4个碳原子在相对的4个顶点上,所以为:
 .
.故答案为:
 .
.(4)△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol.
故答案为:+236 kJ/mol.
点评:本题考查了熔点大小的判断、反应热的计算等知识点,注意反应热中硅的键能,在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键,此点为易错点.

练习册系列答案
相关题目
 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.