摘要:12.(安徽省怀远三中2009届高三高考冲刺卷.理综1)下列实验中叙述正确的一项是 A.摩尔根通过对果蝇性状的研究.发现了基因分离规律 B.在利用洋葱根尖做观察植物细胞有丝分裂的实验中.可以在高倍显微镜下观察到洋葱分生区细胞连续进行有丝分裂的细胞图像 C.艾弗里在格里菲斯的肺炎双球菌转化实验基础上通过研究.首先证明了DNA是生物界中所有生物主要的遗传物质 D.用纸层析法分离叶绿体中的色素.四种色素在层析液中扩散速度最快和溶解度最小的分别是胡萝卜素和叶绿素b
网址:http://m.1010jiajiao.com/timu_id_4009951[举报]
(安徽怀远二中2009届高三上学期第四次月考,化学,4)下列实验操作或所记录的数据合理的是
A.NaOH溶液可保存在玻璃塞的试剂瓶中
B.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中
C.一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3
D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉
查看习题详情和答案>>(2010?杭州一模)一实验小组的同学查阅了20℃时,一些物质的溶解度数据:
并做了如下四个实验:
实验一:取氯化钡固体配成饱和溶液,再向其中加入硝酸铵固体至恰好不溶为止.
实验二:向上述溶液中加入一定量氢氧化钠溶液,发现产生大量白色沉淀,并闻到刺激性气体气味.将所得沉淀反复水洗后分成两份.
实验三:向一份沉淀中加入足量稀盐酸.
实验四:向另一份沉淀中加入足量稀硫酸,再加足量稀盐酸.
回答下列问题:
(1)实验二中发生的化学反应的离子方程式为
(2)实验三中观察到的实验现象为
(3)实验四中观察到的实验现象为
查看习题详情和答案>>
| 物质 | Ba(NO3)2 | NH4Cl | BaCl2 | NH4NO3 | NaCl | Ba(OH)2 |
| 溶解度 | 8.3 | 27.3 | 26.3 | 63.5 | 26.4 | 4.3 |
实验一:取氯化钡固体配成饱和溶液,再向其中加入硝酸铵固体至恰好不溶为止.
实验二:向上述溶液中加入一定量氢氧化钠溶液,发现产生大量白色沉淀,并闻到刺激性气体气味.将所得沉淀反复水洗后分成两份.
实验三:向一份沉淀中加入足量稀盐酸.
实验四:向另一份沉淀中加入足量稀硫酸,再加足量稀盐酸.
回答下列问题:
(1)实验二中发生的化学反应的离子方程式为
NH4++OH-═NH3↑+H2O、Ba2++2OH-═Ba(OH)2↓
NH4++OH-═NH3↑+H2O、Ba2++2OH-═Ba(OH)2↓
.(2)实验三中观察到的实验现象为
沉淀溶解
沉淀溶解
.(3)实验四中观察到的实验现象为
加入硫酸无明显现象,再加稀盐酸沉淀不溶解
加入硫酸无明显现象,再加稀盐酸沉淀不溶解
;相关的化学方程式为Ba(OH)2+H2SO4═BaSO4+2H2O
Ba(OH)2+H2SO4═BaSO4+2H2O
.据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐.发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是
(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):
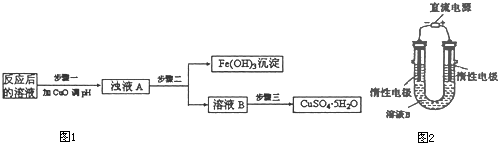
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
步骤一应调节溶液的pH范围是
②步骤三中的具体操作方法是
(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
O2(g)=Cu2O(s)△H=-12kJ?mol-1
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=
查看习题详情和答案>>
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是
Fe和CuFeS2中的S
Fe和CuFeS2中的S
.(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):

①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
3.2≤pH<4.7
3.2≤pH<4.7
.请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因加入CuO与H+反应使c(H+)减小,c(OH-)增大,使溶液中c(Fe3+)?c3(OH-)>Ksp[Fe(OH)3],导致Fe3+生成沉淀而除去
加入CuO与H+反应使c(H+)减小,c(OH-)增大,使溶液中c(Fe3+)?c3(OH-)>Ksp[Fe(OH)3],导致Fe3+生成沉淀而除去
.②步骤三中的具体操作方法是
蒸发浓缩,冷却结晶
蒸发浓缩,冷却结晶
.(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,总反应的方程式是2CuSO4+2H2O
2Cu+2H2SO4+O2↑
| ||
2CuSO4+2H2O
2Cu+2H2SO4+O2↑
.
| ||
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
| 1 |
| 2 |
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=
-193.3kJ?mol-1
-193.3kJ?mol-1
.科学家发现具有2、8、20、28、50、82、114、126等数目的质子或中子的微粒具有特别的稳定性,并将这些偶数称为“幻数”,具有“双幻数”的:
He、
Ni、
Sn、
Pb等元素特别稳定.根据此信息判断下列说法中不正确的是( )
4 2 |
56 28 |
132 50 |
208 82 |
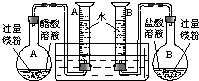 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出]
A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出]
,其改进方法是除去A、B量筒口的胶塞
除去A、B量筒口的胶塞
.(2)改进装置后,检查一侧装置的气密性的方法是
将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气
将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气
.(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
100mL容量瓶、玻璃棒
100mL容量瓶、玻璃棒
.正确操作,记录得到下表中部分实验数据.分析数据,观察实验装置图,回答下列问题:
| A烧瓶中 | B烧瓶中 | 20℃、101kPa 50mL量筒内气体读数 |
反应时间 | |
| A瓶 | B瓶 | |||
| 40mL0.1mol/L 醋酸溶液 |
40mL0.1mol/L 盐酸溶液 |
5mL | t(a1)=155s | t(b1)=7s |
| 10mL | t(a2)=310s | t(b2)=16s | ||
| 15mL | t(a3)=465s | t(b3)=30s | ||
| 20mL | t(a4)=565s | t(b4)=64s | ||
| … | … | … | ||
| 44.8mL | t(an)=865s | t(bn)=464s | ||
开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
;②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是可能不存在电离平衡;由t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.(5)通过该实验可得到的结论是(回答出两点即可):①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快
;②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
.