网址:http://m.1010jiajiao.com/timu_id_4006990[举报]
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:
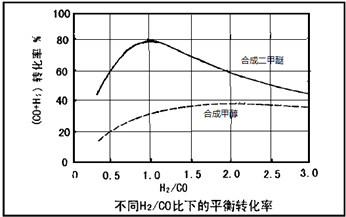
①合成二甲醚的最佳H2/CO比为
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率
铜、硫及其化合物在工业上有着重要的应用.工业上以辉铜矿(主要成分Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) ΔH=-768.2 KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH=+116.0 KJ·mol-1
(1)反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 ΔH=________.
(2)SO2气体直接排放会污染大气,对环境造成的后果是________,工业上常用氨水吸收硫酸厂尾气中的SO2,反应的化学方程式为________.
(3)该工艺炼铜的副产品SO2常用于制硫酸,其中重要的一步反应为:
2SO2(g)+O2(g)若在一个2 L的容器中充入0.4 mol SO2、0.2 mol O2和0.4 mol SO3发生上述反应.①当反应达到平衡时,各物质的浓度可能是________(选填字母标号).
A.c(SO2)=0.3 mol·L-1、c(O2)=0.15 mol·L-1
B.c(SO3)=0.4 mol·L-1
C.c(O2)=0.2 mol·L-1或c(SO2)=0.4 mol·L-1
D.c(SO3)=0.3 moI·L-1
②对于上述可能的情况,达到平衡时的平衡常数为________.
③某温度下,若将等体积的SO2和O2混合,达平衡时SO2的转化率为80%,则升高温度时SO2的转化率将________(填“增大”、“减小”或“不变”).
(4)铜和硫直接化合生成Cu2S,Cu2S和CuS都是黑色固体,都能溶于硝酸,它们高温灼烧的产物相同,鉴别CuS和Cu2S的合理方法是________.
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
(1)反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
(2)SO2气体直接排放会污染大气,对环境造成的后果是
(3)该工艺炼铜的副产品SO2常用于制硫酸,其中重要的一步反应为:2SO2(g)+O2(g)?2SO3(g)△H<0
若在一个2L的容器中充入0.4molSO2、0.2molO2和0.4molSO3发生上述反应.
①当反应达到平衡时,各物质的浓度可能是
A.c(SO2)=0.3mol?L-1、c(O2)=0.15mol?L-1
B.c(SO3)=0.4mol?L-1
C.c(SO3)=0.3mol?L-1
D.c(O2)=0.2mol?L-1或c(SO2)=0.4mol?L-1
②对于上述可能的情况,达到平衡时的平衡常数为
③某温度下,若将等体积的SO2和O2混合,达平衡时SO2的转化率为80%,则升高温度时SO2的转化率将
(4)铜和硫直接化合生成Cu2S,Cu2S和CuS都是黑色固体,都能溶于硝酸,它们高温灼烧的产物相同,鉴别CuS和Cu2S的合理方法是
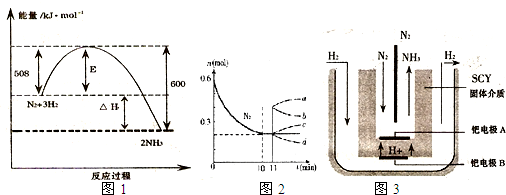
(1)如图1表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
①写出氮气与氢气合成氨的热化学反应方程式:
| ||
| ||
②对于合成氨的反应下列说法正确的是
A、该反应在任意条件下都可以自发进行
B、加入催化剂,能使该反应的E和△H都减小
C、若反应在298K、398K时的化学平衡常数分别为K1、K2,K1>K2
D、该反应属于人工固氮
(2)现在普遍应用的工业合成氮的方法N2+3H2?2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高.
①能使该反应的反应速率增大,且平衡向正方向移动的措施是
A、使用的更高效催化剂
B、升高温度
C、及时分离出氨气
D、冲入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下、2L的密闭容器中发生N2+3H2?2NH3的反应,如图2表示N2的物质的量随时间的变化曲线.用H2表示0~10min内该反应的平速率v(H2)=
A、a B、b C、c D、d
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通入一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图3).
请回答:铠电极是电解池的
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜[Cu(NH3)2]AC溶液(AC=CH3COO-)来吸收合成气中的一氧化碳,其反应原理为:[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC?CO(aq)△H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol;反应b:CO(g)+2H2(g)?CH3OH(g)△H<0
①对于反应a,某温度下,将4.0mol CO2(g)和12.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为
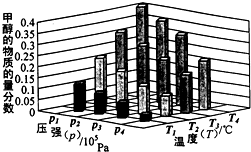
②对于反应b,某温度下,将1.0mol CO(g)和2.0mol H2(g)充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,于温和压强的关系判断正确的是
A.p3>p2,T3>T2 B.p2>p4,T4>T2 C.p1>p3,T1>T3 D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是
A.逆反应速率先增大后减小
B.反应物的体积百分含量减小
C.正反应速率先增大后减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ,请写出表示二甲醚燃烧热的热化学方程式