摘要:答案:(1)增大硫酸浓度,加热升高温度,边加硫酸边搅拌 (2)滤渣Ⅰ主要成分有Fe(OH)3.Al(OH)3 (3)从滤液Ⅱ中可回收利用的主要物质有CaSO4.Na2SO4 (4)①该反应的生成物为Mg(ClO3)2和NaCl的混合溶液.NaCl的溶解度随温度变化不大.Mg(ClO3)2的溶解度随温度升高而升高.利用两物的溶解度差异.通过加热蒸发浓缩.冷却结晶.过滤.将Mg(ClO3)2与NaCl分离.制得Mg(ClO3)2. ②因为在相同温度向下NaCl的溶解度最小.所以在冷却结晶过程中.会有少量NaCl随Mg(ClO3)2析出,重结晶
网址:http://m.1010jiajiao.com/timu_id_4006071[举报]
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.

I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察
(3)本实验在设计上有无缺失之处?若有请答出改进方案
II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理
查看习题详情和答案>>

I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
,C装置中盛放的液体药品的名称是浓硫酸
浓硫酸
.(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察
C中两导管口气泡的产生速率
C中两导管口气泡的产生速率
得知.(3)本实验在设计上有无缺失之处?若有请答出改进方案
有,应在EF之间连接一个防倒吸装置
有,应在EF之间连接一个防倒吸装置
;(若无,此问可不答)II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式
4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以)
| ||
4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以)
.
| ||
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理
将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出
将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基 本一致,那么C处的广口瓶应改为U形管或干燥管
U形管或干燥管
,所装药品为碱石灰(其他合理答案亦可)
碱石灰(其他合理答案亦可)
.硫酸锌是制备荧光粉的原料之一.工业上用锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下:

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7、6.5、9.6.
(1)浸取过程中,为提高浸出效率可采用的措施有
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②
(3)氧化过程中,H2O2发生反应的离子方程式为
(4)加入适量Ca(OH)2调节溶液pH、促进Fe3+水解,则Fe3+水解反应的平衡常数表达式K=
;Ca(OH)2不能过量的原因是
查看习题详情和答案>>

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7、6.5、9.6.
(1)浸取过程中,为提高浸出效率可采用的措施有
将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可)
将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可)
.(任答一条)ZnO与稀硫酸反应的化学方程式为ZnO+H2SO4(稀)═ZnSO4+H2O
ZnO+H2SO4(稀)═ZnSO4+H2O
.(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②
除去Cu2+
除去Cu2+
.(3)氧化过程中,H2O2发生反应的离子方程式为
H2O2+2Fe2++2H+═2Fe3++2H2O
H2O2+2Fe2++2H+═2Fe3++2H2O
.(4)加入适量Ca(OH)2调节溶液pH、促进Fe3+水解,则Fe3+水解反应的平衡常数表达式K=
| c3(H+) |
| c(Fe3+) |
| c3(H+) |
| c(Fe3+) |
防止生成Zn(OH)2
防止生成Zn(OH)2
.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.工业上常采用NaClO氧化法生产,其生产工艺如下:

主要反应为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH.
(1)写出反应①的离子方程式:
(2)从“混合物II”中分离出K2FeO4后,会有副产品
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.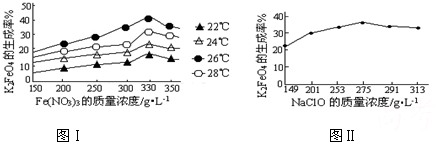
根据图分析:工业生产中最佳温度为
(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol?L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅲ.该实验的目的是
(6)FeO42-在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O.
查看习题详情和答案>>

主要反应为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH.
(1)写出反应①的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(2)从“混合物II”中分离出K2FeO4后,会有副产品
NaNO3、NaCl、NaOH
NaNO3、NaCl、NaOH
(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途NaNO3作炸药,NaCl用作调味品或氯碱工业原料等
NaNO3作炸药,NaCl用作调味品或氯碱工业原料等
.(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.

根据图分析:工业生产中最佳温度为
26
26
℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为1.2
1.2
.(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用B
B
溶液(填序号).A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol?L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅲ.该实验的目的是
探究温度对FeO42-浓度的影响(或其他合理答案)
探究温度对FeO42-浓度的影响(或其他合理答案)
.
(6)FeO42-在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是
C
C
(填字母).A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O.
(1)现有以Pt为电极的氢氧燃料电池和以Pt为电极的电解池。若燃料电池和电解池中都为氢氧化钠溶液,则:
①燃料电池中两极上进行的电极反应分别为
a.正极_____________________________________________;
b.负极_____________________________________________。
②电解池中两极上进行的电极反应分别为
a.阴极_____________________________________________;
b.阳极_____________________________________________。
(2)将(1)中的“氢氧化钠溶液”改为“硫酸溶液,”其他同(1),试写出答案。
(3)若燃料电池中电解质溶液为氢氧化钠溶液,但向负极通入的气体不是氢气,而是一氧化碳(或甲烷,或乙烯,或乙炔),则原电池中两极上进行的电极反应、电池总反应和电解质溶液pH的变化分别是:
当通入一氧化碳时:
a.正极_____________________________________________;
b.负极_____________________________________________;
c.电池总反应为_____________________________________;
d.电解质溶液pH的变化为_________。(填“增大”“减小”或“不变”)
查看习题详情和答案>>