题目内容
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.工业上常采用NaClO氧化法生产,其生产工艺如下:

主要反应为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH.
(1)写出反应①的离子方程式:
(2)从“混合物II”中分离出K2FeO4后,会有副产品
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.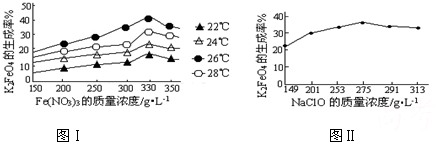
根据图分析:工业生产中最佳温度为
(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol?L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅲ.该实验的目的是
(6)FeO42-在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O.

主要反应为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH.
(1)写出反应①的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(2)从“混合物II”中分离出K2FeO4后,会有副产品
NaNO3、NaCl、NaOH
NaNO3、NaCl、NaOH
(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途NaNO3作炸药,NaCl用作调味品或氯碱工业原料等
NaNO3作炸药,NaCl用作调味品或氯碱工业原料等
.(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.

根据图分析:工业生产中最佳温度为
26
26
℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为1.2
1.2
.(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用B
B
溶液(填序号).A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol?L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅲ.该实验的目的是
探究温度对FeO42-浓度的影响(或其他合理答案)
探究温度对FeO42-浓度的影响(或其他合理答案)
.
(6)FeO42-在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是
C
C
(填字母).A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O.
分析:(1)氯气是酸性气体,能和烧碱溶液反应,可以据此来生产“84”消毒液;
(2)根据流程确定混合物Ⅰ的组成以及经过反应②之后所得混合物II的组成,从中分离出K2FeO4后,就会发现得到的副产品是什么,根据物质的性质决定用途,结合物质的常见用途来回答;
(3)寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面;
(4)洗涤剂的选择要求:要对K2FeO4水解能起到抑制作用的试剂;
(5)将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况;
(6)根据图象的内容来分析图象所描述的意义.
(2)根据流程确定混合物Ⅰ的组成以及经过反应②之后所得混合物II的组成,从中分离出K2FeO4后,就会发现得到的副产品是什么,根据物质的性质决定用途,结合物质的常见用途来回答;
(3)寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面;
(4)洗涤剂的选择要求:要对K2FeO4水解能起到抑制作用的试剂;
(5)将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况;
(6)根据图象的内容来分析图象所描述的意义.
解答:解:(1)氯气是酸性气体,能和烧碱溶液反应,反应实质为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)根据流程确定混合物Ⅰ的组成为氯化钠、次氯酸钠以及氢氧化钠的混合物,经过反应②之后所得混合物II的组成有NaNO3、NaCl、NaOH、K2FeO4,从中分离出K2FeO4后,得到的副产品是NaNO3、NaCl、NaOH,其中NaNO3作炸药,NaCl用作调味品或氯碱工业原料等;故答案为:NaNO3、NaCl、NaOH;NaNO3作炸药,NaCl用作调味品或氯碱工业原料等;
(3)寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面,所以工业生产中最佳温度为26℃,因为在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为
=1.2,故答案为:26;1.2;
(4)洗涤剂的选择要求:要对K2FeO4水解能起到抑制作用的试剂,在选项中,A能让K2FeO4水解,B中醋酸钠水解显碱性,对K2FeO4水解能起到抑制作用,C和D中的铵根和三价铁离子易水解,且水解后显酸性,对K2FeO4水解能起到促进作用,故选B,故答案为:B;
(5)将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况,故答案为:探究温度对FeO42-浓度的影响;
(6)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B、向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故B错误;
C、pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:C.
(2)根据流程确定混合物Ⅰ的组成为氯化钠、次氯酸钠以及氢氧化钠的混合物,经过反应②之后所得混合物II的组成有NaNO3、NaCl、NaOH、K2FeO4,从中分离出K2FeO4后,得到的副产品是NaNO3、NaCl、NaOH,其中NaNO3作炸药,NaCl用作调味品或氯碱工业原料等;故答案为:NaNO3、NaCl、NaOH;NaNO3作炸药,NaCl用作调味品或氯碱工业原料等;
(3)寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面,所以工业生产中最佳温度为26℃,因为在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为
| 330 |
| 275 |
(4)洗涤剂的选择要求:要对K2FeO4水解能起到抑制作用的试剂,在选项中,A能让K2FeO4水解,B中醋酸钠水解显碱性,对K2FeO4水解能起到抑制作用,C和D中的铵根和三价铁离子易水解,且水解后显酸性,对K2FeO4水解能起到促进作用,故选B,故答案为:B;
(5)将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况,故答案为:探究温度对FeO42-浓度的影响;
(6)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B、向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故B错误;
C、pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:C.
点评:本题是一道综合知识题目,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为