摘要:氟化氢水溶液叫氢氟酸.它应贮存在( ) A.玻璃瓶中 B.铅容器中 C.瓷瓶中 D.塑料瓶中
网址:http://m.1010jiajiao.com/timu_id_3997251[举报]
下列叙述正确的是( )
| A、氧化镁的晶格能大于氧化钙,由岩浆晶出规则可推测氧化钙先从岩浆中析出 | B、氟化氢水溶液中氢键的表示形式共有4种 | C、N2H4、CO32-、H3O+的中心原子都是sp3 杂化 | D、P4和CH4分子都是正四面体结构且键角都为109°28′ |
 (2012?潍坊一模)[物质结构与性质]
(2012?潍坊一模)[物质结构与性质]碳氢氟氮硅等非金属元素与人类的生产生活息息相关.回答下列问题:
(1)写出硅原子的电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.C、Si、N的电负性由大到小的顺序是N>C>Si
N>C>Si
.(2)氟化氢水溶液中存在氢键有
4
4
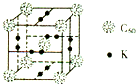
种.(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为
3:1
3:1
.(4)继C60后,科学家又合成了Si60、N60.请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:
破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多
破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多
.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).请根据以上信息回答下列问题: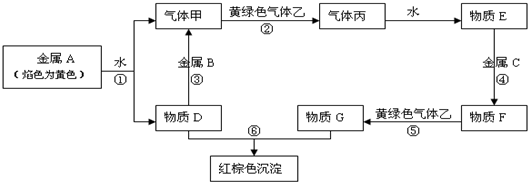
(1)写出下列物质的化学式:B 、C 、乙
(2)A物质在空气中燃烧的产物是 色的粉末,它与CO2反应放出的气体是 ,该反应可应用于
(3)写出反应①和③的离子反应方程式: , .
(4)在物质F中加入NaOH溶液,现象为 ,发生反应的化学方程式为 、 .
(5)丙在空气中遇水蒸气产生 现象,它的水溶液叫 ,检验其阴离子所用试剂是 .
查看习题详情和答案>>

(1)写出下列物质的化学式:B
(2)A物质在空气中燃烧的产物是
(3)写出反应①和③的离子反应方程式:
(4)在物质F中加入NaOH溶液,现象为
(5)丙在空气中遇水蒸气产生
下列关于甲醛的叙述不正确的是( )
| A、甲醛常用于制造酚醛树指、脲醛树脂、维纶、染料等 | B、35%~40%的甲醛水溶液叫福尔马林,具有很好的防腐杀菌作用 | C、甲醛能够发生银镜反应,也能发生加成反应 | D、甲醛在通常状况下为液体、易挥发,具有剌激性气味 |