摘要:课程标准将“化学实验基础 专题的具体内容标准确定为:“1.体验科学探究的过程.学习运用以实验为基础的实证研究方法.2.初步学会物质的检验.分离.提纯和溶液配制等实验技能.3.树立安全意识.能识别化学品安全使用标识.初步形成良好的实验工作习惯.4.能够独立或与同学合作完成实验.记录实验现象和数据.完成实验报告.并能主动进行交流.5.初步认识实验方案设计.实验条件控制.数据处理等方法在化学学习和科学研究中的应用. 本章对“化学实验基础 专题所确定的上述5个内容标准没有全部涉及.只是在初中化学实验的基础上.选择一些基本的实验知识和基本的操作.学生在初中的学习过程中已经接触到一些实验知识.本章第一节的内容是对初中已有的有关实验知识的拓宽和提升.初中学生实验过程中已经涉及一些实验安全问题.分离的方法.在初中已经初步了解了粗盐提纯的方法.蒸馏的简易装置.在本章中要在初中学习的基础上巩固粗盐提纯的操作.掌握蒸馏的实验室正规的装置和规范的操作.学习新的分离提纯的方法--萃取.还要了解有关离子的验检.可以看到第一节中学生学习的重点是混合物的分离与离子的检验.在分离提纯的学习过程中纯盐提纯有关的操作学生比较熟悉.其学习的难度不大.但对于课本中提到的提纯后溶液依然存在的杂质如何设计简单的实验进行分离提纯.对学生而言涉及物质的性质.和对性质的灵活应用.需要一定分析和逻辑思维能力.是学生学习的难点.蒸馏和萃取的实验学生比较陌生.所以学习过程中也存在一定的困难. 学生在初中初步了解了一些微观离子的存在.和宏观物理量--质量.但并没有把两者真正联系起来.在浓度方面学习了质量分数.在本章的第二节的学习过程中涉及到宏观的一些物理量(物质的量.物质的量浓度.物质的量.摩尔质量)与微观粒子间的关系.以及这些物理量之间的相互转化和物质的量浓度的配制方法等知识.这些内容对学生而言是全新的.是以后学习和研究化学学科的必备的定量工具.在第二节的几个概念中.物质的量的概念相对比较抽象.是连接宏观和微观的桥梁.学生在理解上存在一定的困难.一定物质的量浓度的溶液的配制方法中不但有实验操作.还涉及所学习的新的概念的简单计算.所以学生在学习的过程中也会存在一定的难度. 综合上述原因.本章的重难点设置如下: 教学重点:1.混合物的分离.提纯与离子的检验.
网址:http://m.1010jiajiao.com/timu_id_3993362[举报]
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
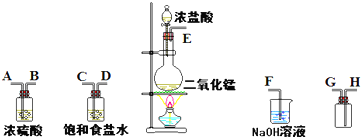
(1)连接上述仪器的正确顺序(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
②NaOH溶液中发生的反应:
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
③当有0.2mole-转移时被氧化的HCl的质量是
④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
查看习题详情和答案>>

(1)连接上述仪器的正确顺序(填各接口处的字母):
E
E
接C
C
;D
D
接A
A
;B
B
接H
H
;G
G
接F
F
.(2)装置中,饱和食盐水的作用是
除去氯气中的HCl杂质
除去氯气中的HCl杂质
;NaOH溶液的作用是吸收过量的氯气
吸收过量的氯气
.(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
试纸变蓝
试纸变蓝
,反应方程式2KI+Cl2═2KCl+I2
2KI+Cl2═2KCl+I2
.(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
| ||
②NaOH溶液中发生的反应:
2NaOH+Cl2═NaCl+NaClO+H2O
2NaOH+Cl2═NaCl+NaClO+H2O
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
1:5
1:5
;③当有0.2mole-转移时被氧化的HCl的质量是
7.3g
7.3g
;该反应中被氧化和未被氧化的盐酸的物质的量之比是5:3
5:3
,④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
D
D
.A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,
标有“0”刻度的是(填序号)
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺.在下列仪器中,没有用到“磨砂”工艺处理的有(填序号)
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管,
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体.可供选择的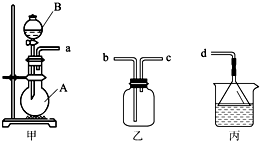 液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:
液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满.若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为
②若在乙中收集氨气,气体流经装置的顺序是:a→
查看习题详情和答案>>
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,
标有“0”刻度的是(填序号)
dgf
dgf
.(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺.在下列仪器中,没有用到“磨砂”工艺处理的有(填序号)
af
af
.a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管,
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体.可供选择的
 液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:
液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为
浓盐酸
浓盐酸
,制取该气体利用了B的性质有吸水性
吸水性
、溶于水放出大量热
溶于水放出大量热
.通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满.若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为
NaOH或CaO或碱石灰
NaOH或CaO或碱石灰
;②若在乙中收集氨气,气体流经装置的顺序是:a→
c
c
→b
b
→d(填接口代号).实验室配制480mL 0.1mol?L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体
(2)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
(3)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
(4)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
(5)若实验时遇到下列情况,将使溶液的浓度偏低的是
A.配制前设有将容量瓶中的水除尽;
B.试剂溶解后,在转移到容量瓶中时有洒出;
C.忘记将洗涤液转入容量瓶;
D.定容、摇匀、静置后发现凹液面低于刻度线又加水至刻度线;
E.定容时俯视刻度线.
查看习题详情和答案>>
(1)应用托盘天平称取十水碳酸钠晶体
14.3
14.3
g,应选用500
500
m L的容量瓶.(2)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
①③⑤
①③⑤
.(填数字符号)(3)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
dbac
dbac
.(填写字母,每种仪器只能选择一次)(4)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
2
2
种用途.(填写数字)(5)若实验时遇到下列情况,将使溶液的浓度偏低的是
BCD
BCD
.A.配制前设有将容量瓶中的水除尽;
B.试剂溶解后,在转移到容量瓶中时有洒出;
C.忘记将洗涤液转入容量瓶;
D.定容、摇匀、静置后发现凹液面低于刻度线又加水至刻度线;
E.定容时俯视刻度线.
(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3)
(3)FeCl3(FeCl2)
(二)海水中含有大量的氯化镁,从海水中提取镁的生产流程如图1所示:
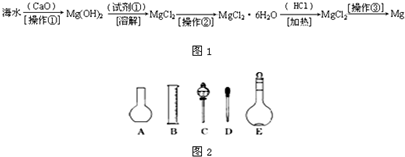
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式
操作①主要是指
(三)实验室配制480ml 0.1mol?L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体
(2)如图2所示的仪器配制溶液肯定不需要的是
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是
A.配制前设有将容量瓶中的水除尽; B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠; D.称量碳酸钠晶体时所用砝码生锈; E.定容时仰视刻度线.
查看习题详情和答案>>
(1)MgO (Al2O3)
NaOH溶液
NaOH溶液
(2)Cl2(HCl)饱和NaCl溶液
饱和NaCl溶液
(3)FeCl3(FeCl2)
氯气或氯水
氯气或氯水
(4)NaHCO3溶液(Na2CO3)CO2
CO2
(二)海水中含有大量的氯化镁,从海水中提取镁的生产流程如图1所示:

回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式
CaO+MgCl2+H2O=Mg(OH)2+CaCl2
CaO+MgCl2+H2O=Mg(OH)2+CaCl2
;操作①主要是指
过滤
过滤
;试剂①可选用HCl
HCl
;操作②是指蒸发浓缩,冷却结晶,过滤
蒸发浓缩,冷却结晶,过滤
;经操作③最终可得金属镁.(三)实验室配制480ml 0.1mol?L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体
14.3
14.3
g.(2)如图2所示的仪器配制溶液肯定不需要的是
AC
AC
(填序号),本实验所需玻璃仪器E规格为500
500
mL.(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
①③⑤
①③⑤
.(填数字符号)(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
dbac
dbac
.(填写字母,每种仪器只能选择一次)(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
2
2
种用途.(填写数字)(6)若实验时遇到下列情况,将使溶液的浓度偏低的是
CE
CE
.A.配制前设有将容量瓶中的水除尽; B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠; D.称量碳酸钠晶体时所用砝码生锈; E.定容时仰视刻度线.
 (1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=
(1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n= (用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是
(用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是