网址:http://m.1010jiajiao.com/timu_id_3989498[举报]
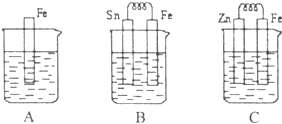 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为
(3)C中被腐蚀的金属是
比较A、B、C中铁被腐蚀的速率,由 快到慢的顺序是
II.现有常温下的6份溶液:①0.01mol?L-1CH3COOH溶液;②0.01mol?L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为
(3)将溶液同等稀释10倍后溶液的pH:③
(15分) ![]() I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
![]()

(1)A中反应的离子方程式为 ;
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”);
(3)C中被腐蚀的金属是 ,总反应式为 比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
II.现有常温下的6份溶液:①0.01 mol?L-1CH3COOH溶液;②0.01 mol?L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01 mol? L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01 mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为 ;
(3)将溶液同等稀释10倍后溶液的pH:③ ④,⑤ ⑥(选填“>”或“<”或“=”)。
查看习题详情和答案>>(24分)(1)如右图所示,用两根质量相等的银棒作电极电解CuCl2溶液,电解一段时间后,①现象为 ,
②a、b两极比较, 极重,写出a极上发生的反应 。
(2)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
I.接通电源,经过一段时间后,测得丙中K2SO4的浓度变为10.47%,乙中c电极质量增加。据此回答下列问题。
①电源的N端为 极;
②电极b上发生的电极反应为: 。
③电极b上生成的气体在标准状况下的体积为: L。
④电极c的质量变化是: g。
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液: , 。
乙溶液: , 。
丙溶液: , 。
II.如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
, 。
查看习题详情和答案>>
(24分)(1)如右图所示,用两根质量相等的银棒作电极电解CuCl2溶液,电解一段时间后,①现象为 ,
②a、b两极比较, 极重,写出a极上发生的反应 。
(2)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。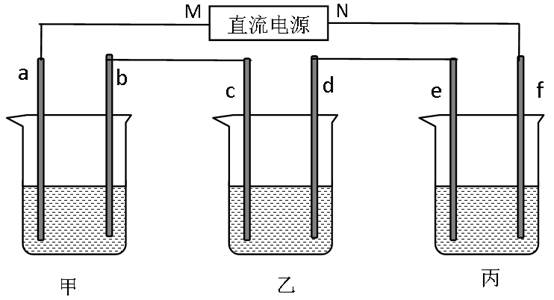
I.接通电源,经过一段时间后,测得丙中K2SO4的浓度变为10.47%,乙中c电极质量增加。据此回答下列问题。
①电源的N端为 极;
②电极b上发生的电极反应为: 。
③电极b上生成的气体在标准状况下的体积为: L。
④电极c的质量变化是: g。
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液: , 。
乙溶液: , 。
丙溶液: , 。
II.如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
, 。
(24分)(1)如右图所示,用两根质量相等的银棒作电极电解CuCl2溶液,电解一段时间后,①现象为 ,
②a、b两极比较, 极重,写出a极上发生的反应 。

(2)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。

I.接通电源,经过一段时间后,测得丙中K2SO4的浓度变为10.47%,乙中c电极质量增加。据此回答下列问题。
①电源的N端为 极;
②电极b上发生的电极反应为: 。
③电极b上生成的气体在标准状况下的体积为: L。
④电极c的质量变化是: g。
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液: , 。
乙溶液: , 。
丙溶液: , 。
II.如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
, 。
查看习题详情和答案>>