题目内容
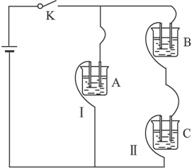
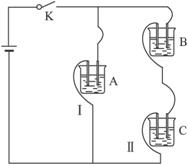
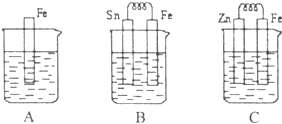 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为
(3)C中被腐蚀的金属是
比较A、B、C中铁被腐蚀的速率,由 快到慢的顺序是
II.现有常温下的6份溶液:①0.01mol?L-1CH3COOH溶液;②0.01mol?L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为
(3)将溶液同等稀释10倍后溶液的pH:③
分析:Ⅰ、(1)铁的化学性质,能与酸反应;
(2)根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
(3)根据金属活泼性判断原电池的正负极,得出正确结论.
Ⅱ、(1)比较四种溶液中的H+、OH-浓度大小,可确定对水的电离的影响;
(2)根据酸碱混合反应后溶液的组成情况来计算溶液的pH;
(3)根据电解质稀释后溶液的pH的变化结合弱电解质电离平衡的移动来回答.
(2)根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
(3)根据金属活泼性判断原电池的正负极,得出正确结论.
Ⅱ、(1)比较四种溶液中的H+、OH-浓度大小,可确定对水的电离的影响;
(2)根据酸碱混合反应后溶液的组成情况来计算溶液的pH;
(3)根据电解质稀释后溶液的pH的变化结合弱电解质电离平衡的移动来回答.
解答:解:Ⅰ、(1)铁与硫酸反应的离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
(3)锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑,金属的腐蚀速率:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,A属于化学腐蚀,B中金属Fe为负极,C中金属铁是正极,所以腐蚀速率是:B>A>C,故答案为:Zn;Zn+2H+=Zn2++H2↑;B>A>C;
II.(1)0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液是醋酸钠水溶液,其中醋酸根离子水解对水的电离起到促进作用,水的电离程度最大,而酸或是碱都对水的电离起抑制作用,③pH=13的氨水中水电离出的氢离子浓度是10-13mol/L,pH=13的NaOH溶液中,水电离出的氢离子浓度也是10-13mol/L,水的电离程度相同的,故答案为:⑤;③④;
(2)若将②、④混合后,0.01mol?L-1HCl溶液和pH=13的NaOH溶液所得溶液pH=12,则氢氧化钠剩余,设盐酸、氢氧化钠溶液的体积分别为:V1、V2,所以0.1V2-0.01V1=0.01(V1+V2),解得:V1:V2=2:9,故答案为:2:9;
(3)氨水是弱碱,氢氧化钠是强碱,稀释后pH均会减小,但是氨水减小的程度小,所以pH是③>④,0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液是醋酸钠溶液,显示碱性;0.01mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液,是氯化钠溶液,显示中性,将溶液同等稀释10倍,pH是⑤>⑥.
故答案为:>;>.
(2)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
(3)锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑,金属的腐蚀速率:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,A属于化学腐蚀,B中金属Fe为负极,C中金属铁是正极,所以腐蚀速率是:B>A>C,故答案为:Zn;Zn+2H+=Zn2++H2↑;B>A>C;
II.(1)0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液是醋酸钠水溶液,其中醋酸根离子水解对水的电离起到促进作用,水的电离程度最大,而酸或是碱都对水的电离起抑制作用,③pH=13的氨水中水电离出的氢离子浓度是10-13mol/L,pH=13的NaOH溶液中,水电离出的氢离子浓度也是10-13mol/L,水的电离程度相同的,故答案为:⑤;③④;
(2)若将②、④混合后,0.01mol?L-1HCl溶液和pH=13的NaOH溶液所得溶液pH=12,则氢氧化钠剩余,设盐酸、氢氧化钠溶液的体积分别为:V1、V2,所以0.1V2-0.01V1=0.01(V1+V2),解得:V1:V2=2:9,故答案为:2:9;
(3)氨水是弱碱,氢氧化钠是强碱,稀释后pH均会减小,但是氨水减小的程度小,所以pH是③>④,0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液是醋酸钠溶液,显示碱性;0.01mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液,是氯化钠溶液,显示中性,将溶液同等稀释10倍,pH是⑤>⑥.
故答案为:>;>.
点评:本题涉及溶液的pH计算、水的电离平衡等方面知识的综合知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
 IC。若撤去C,并将A、B两溶液混合,混合溶液的电流强度与先前通过A的大小关系为IAB
IC。若撤去C,并将A、B两溶液混合,混合溶液的电流强度与先前通过A的大小关系为IAB  IA。
IA。