网址:http://m.1010jiajiao.com/timu_id_3981664[举报]
中央电视台从2001年6月5日起每天都要报道47个重点城市的空气质量预报。包括SO2和可吸入颗粒的含量。目前测定空气中SO2含量主要用氧化还原反应法。假如给你气体流速管(单位时间内通过气体的体积恒定但无除尘和吸收气体的作用)“¤”、密闭容器“□”、敞口仪器“∪”、导管“-或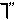 、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下:
、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下: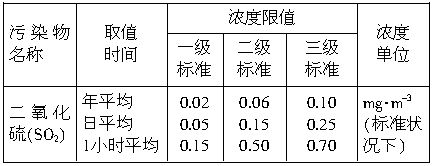
(1)画出测定空气中SO2和可吸入颗粒的含量的实验装置图(并指出仪器中的药品)。
(2)若气体流速管中气体流速为5000cm3?min-1,当140min时20mL0.0001mol?L-1的酸性高锰酸钾溶液恰好退色,则根据我国空气质量标准和测定结果判断所测定地点的空气中SO2的含量属于_________(填数字)级标准(环境)。
(3)若要测定空气中可吸入颗粒的含量,需要测出的数据有__________________________________。
中央电视台自2001年6月5日起,每晚都要预报47个环境保护重点城市的空气质量,它一般将这些城市空气中的 和可吸入颗粒的含量(用
和可吸入颗粒的含量(用 表示)分为8个等级.目前,测定空气中
表示)分为8个等级.目前,测定空气中 含量主要用氧化还原反应.
含量主要用氧化还原反应.
假如给你一个气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用).请设计一个实验装置,测定你所在地区的空气中 和可吸入颗粒的含量.已知:
和可吸入颗粒的含量.已知: 气体和酸性溶液
气体和酸性溶液 溶液反应的离子方程式为:
溶液反应的离子方程式为:

现有药品: 的酸性
的酸性 溶液、颗粒吸附剂、品红试剂、pH试纸.现有仪器:密闭容器用
溶液、颗粒吸附剂、品红试剂、pH试纸.现有仪器:密闭容器用 表示,敞口仪器用
表示,敞口仪器用 表示,导管用
表示,导管用 或
或 表示,气体流速管用
表示,气体流速管用 表示.
表示.
(1)配制200mL 酸性
酸性 溶液,需用仪器有玻璃棒、__________、____________、____________、_____________等.玻璃棒的作用是_______________________、_____________________________.
溶液,需用仪器有玻璃棒、__________、____________、____________、_____________等.玻璃棒的作用是_______________________、_____________________________.
(2)画出测定空气中 和可吸入颗粒含量的实验装置图(并指出仪器中的药品).
和可吸入颗粒含量的实验装置图(并指出仪器中的药品).
(3)若气体流速管中气体流速为 ,当tmin时200mL
,当tmin时200mL 溶液恰好褪色.求空气中
溶液恰好褪色.求空气中 的含量(
的含量( ).
).
(4)若要测定空气中可吸入颗粒的含量,需要测出的数据有_____________________________________________________________.
查看习题详情和答案>>Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得.则该反应的氧化产物与还原产物的物质的量之比是
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图1:

(2)写出电解时发生反应的化学方程式:
| ||
| ||
(3)除去ClO2中的NH3可选用的试剂是
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(4)测定ClO2(如图2)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
③滴定终点的现象是:
④测得通入ClO2的质量m(ClO2)=
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-.2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2mg/L.若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是

(1)若A是乙醇,则C的结构简式是
| ||
| △ |
| ||
| △ |
A.乙醇汽油是一种新型的化合物
B.汽车使用乙醇汽油能减少有害气体的排放
C.工业常用裂化的方法提高汽油的产量
D.用玉米、高粱发酵可以制得乙醇
(2)若A是一种工业制硫酸的含金属元素矿物质主要成分,则A的化学式为
| 催化剂 |
| △ |
| 催化剂 |
| △ |
①物质B的转化率
②求该温度下反应②的平衡常数
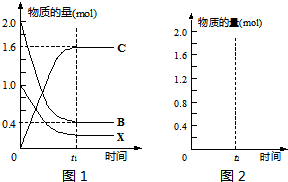
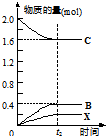
③在上述相同条件下,向相同的容器中投入2mol C,t2时刻达到平衡.请在图2中画出从反应开始至平衡后各物质物质的量与时间的关系图

(1)请参考下述数据填空和回答问题:
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图1所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内.
则该化合物的化学式可表示为
(3)写出Cu+的核外电子排布式
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)某喹喏酮类药物(中心离子是Cu2+)结构如图2,关于该药物的说法正确的是
A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大.
