摘要:少量碘化物的含量可用以下方法进行测定.其步骤如下: ①在中性或弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-, ②煮沸①所得溶液以除去过量的Br2.然后在酸性条件下加入过量的KI溶液.将IO3- 还原为I2,③在②中加淀粉作指示剂.用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6). 通过上述步骤可测得碘化物中I-的含量. (1)写出步骤①②中发生反应的离子方程式. ① ② (2)若样品中有1mol I-.则最后耗用Na2S2O3的物质的量是 (3)若在测定时.准确量取含KI的样品溶液25.00mL.终点时耗用0.100mol/LNa2S2O3溶液20.06mL.则样品溶液中KI的含量(g/L).
网址:http://m.1010jiajiao.com/timu_id_3981611[举报]
少量碘化物的含量可用以下方法进行测定,其步骤如下:
①在中性或弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3- 还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量。
要求:
(1)写出步骤①②中发生反应的离子方程式。
(2)若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00mL,终点时耗用0.100mol/LNa2S2O3溶液20.06mL,试计算样品溶液中KI的含量(g/L)。
查看习题详情和答案>>
①在中性或弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3- 还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量。
要求:
(1)写出步骤①②中发生反应的离子方程式。
(2)若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00mL,终点时耗用0.100mol/LNa2S2O3溶液20.06mL,试计算样品溶液中KI的含量(g/L)。
查看习题详情和答案>>
I.可用于分离或提纯物质的方法有:
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠
(3)除去粗铜中锌、银等金属
(4)除去水中的Na+、SO42-、Cl-等杂质
(5)除去KNO3晶体中混有的少量NaCl
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
请写出结晶水个数(x)的计算公式(用含W1、W2、W3 表示)
.
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=
查看习题详情和答案>>
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠
F
F
;(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠
B
B
;(3)除去粗铜中锌、银等金属
G
G
;(4)除去水中的Na+、SO42-、Cl-等杂质
A
A
;(5)除去KNO3晶体中混有的少量NaCl
D
D
.II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 160(W2-W3) |
| 18(W3-W1) |
| 160(W2-W3) |
| 18(W3-W1) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=
-
| 0.418×2.35 |
| 0.025 |
-
KJ/mol(填数学计算式).[反应后混合液的比热容为4.18J/(g?℃)].| 0.418×2.35 |
| 0.025 |
I.可用于分离或提纯物质的方法有:
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠______;
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠______;
(3)除去粗铜中锌、银等金属______;
(4)除去水中的Na+、S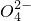 、Cl-等杂质______;
、Cl-等杂质______;
(5)除去KNO3晶体中混有的少量NaCl______.
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=______KJ/mol(填数学计算式).[反应后混合液的比热容为4.18J/(g?℃)]. 查看习题详情和答案>>
类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证此观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同.请填写下表中的相应空格
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是
A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,写出反应的离子方程式
方案1:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜,该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出.该方案中铜作
查看习题详情和答案>>
(1)提出假设:A是FeCl3,B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同.请填写下表中的相应空格
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
2Fe+3Cl2
FeCl3
| ||
2Fe+3Cl2
FeCl3
.
| ||
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是
BD
BD
(填写序号).A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,写出反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.腐蚀后的废液中含有FeCl2、FeCl3、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:方案1:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜,该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
Fe3+>Cu2+>H+>Fe2+
Fe3+>Cu2+>H+>Fe2+
.方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出.该方案中铜作
阴
阴
极,该电极上所发生的电极反应为 (若有多个电极反应,请全部写出)Fe3++e-=Fe2+,Cu2++2e-=Cu,2H++2e-=H2↑
Fe3++e-=Fe2+,Cu2++2e-=Cu,2H++2e-=H2↑
.方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:产生污染性的气体氯气;使用了电解装置成本较高
产生污染性的气体氯气;使用了电解装置成本较高
.类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证此观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同.请填写下表中的相应空格
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | ______ | 固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是______ (填写序号).
A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,写出反应的离子方程式______.腐蚀后的废液中含有FeCl2、FeCl3、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜,该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:______.
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出.该方案中铜作______极,该电极上所发生的电极反应为 (若有多个电极反应,请全部写出)______.方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:______. 查看习题详情和答案>>