网址:http://m.1010jiajiao.com/timu_id_3978596[举报]
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强。某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验。根据要求回答问题: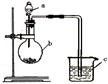
(1)仪器a应盛放的药品是 (填选项)。
A. H2SO4 B. H2SO3 C.H2S D. H2CO3
(2)仪器b应盛放的药品是 (填选项)。
A. Na2SO4 B. Na2CO3 C.NaCl D. CaCO3
(3)仪器c盛放的药品是 ,通过 现象,可以证明得电子能力 比 强。
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强。某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验。根据要求回答问题:

(1)仪器a应盛放的药品是 (填选项)。
A. H2SO4 B. H2SO3 C.H2S D. H2CO3
(2)仪器b应盛放的药品是 (填选项)。
A. Na2SO4 B. Na2CO3 C.NaCl D. CaCO3
(3)仪器c盛放的药品是 ,通过 现象,可以证明得电子能力 比 强。
查看习题详情和答案>>
(1)利用KSCN、H2O2等药品检验反应后的混合液中含有二价铁的实验方法和现象是
| ||
| ||
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色.若再滴加过量新制氯水,却发现红色褪去.同学对红色褪去的原因提出各自的假设.某同学的假设是:溶液中的+3价铁被氧化为更高的价态.”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式
(3)探究高铁酸钾的某种性质.
【实验一】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
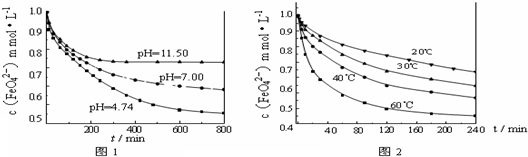

【试验二】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0mmol?L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.则
①实验1的目的是
②实验2可得出的结论是
③高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
用“>”或“<”填空:
(1)酸性:H2CO3________H2SiO3,H2SiO3________H3PO4.
(2)碱性:Ca(OH)2________Mg(OH)2,Mg(OH)2________Al(OH)3.
(3)气态氢化物稳定性:H2O________H2S,H2S________HCl.
(4)还原性:H2O________H2S,H2S________HCl.
(5)酸性:H2SO4________H2SO3,HClO4________HClO.
从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应的水化物的酸性越________;
②元素的金属性越强,其最高价氧化物对应的水化物的碱性越________;
③元素的性越强,其对应的气态氢化物的稳定性越________;
④非金属性越强的元素形成的气态氢化物,其还原性越________;
⑤同种非金属元素形成的含氧酸,其形成酸中该元素的价态越高,其酸性越________.