网址:http://m.1010jiajiao.com/timu_id_3978420[举报]
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于()
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
查看习题详情和答案>>![]()
![]()
![]() (09全国卷)
(09全国卷)![]()
![]() 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
![]()
![]()

![]()
![]()
![]()
![]() 回答下列问题:
回答下列问题:
![]()
![]() (1)A中加入的物质是_______.
(1)A中加入的物质是_______.![]()
![]() 发生反应的化学方程式是____________;
发生反应的化学方程式是____________;
![]()
![]() (2)B中加入的物质是______,其作用是____________:
(2)B中加入的物质是______,其作用是____________:
![]()
![]() (3)实验时在C中观察到得现象是_______________,
(3)实验时在C中观察到得现象是_______________,![]()
![]() 发生反应的化学方程式是______________________;
发生反应的化学方程式是______________________;
![]()
![]() (4) 实验时在D中观察到得现象是___,
(4) 实验时在D中观察到得现象是___,![]()
![]() D中收集到的物质是____,检验该物质的方法和现象是____________.
D中收集到的物质是____,检验该物质的方法和现象是____________.
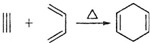 ,如果要合成
,如果要合成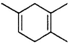 所用的原始原料可以是
所用的原始原料可以是A.2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D.,3-二甲基-l,3-丁二烯和丙炔
II(A~G都是有机化合物,它们的转化关系如下:
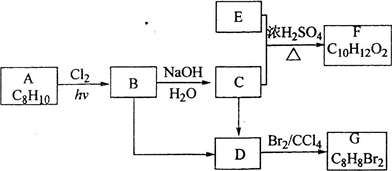
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8g C02和3.6g H20;E的蒸气与氢气的相对密度为30,则E的分子式为
(2)A为一取代芳烃,B中含有一个甲基.由B生成C的化学方程式为
| NaOH |
| △ |
| NaOH |
| △ |
(3)由B生成D、由C生成D的反应条件分别是
(4)由A生成B、由D生成G的反应类型分别是
(5)F存在于栀子香油中,其结构简式为


(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有


(2010 ·海南三亚)已知:CH3CH2CH2CH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l);DH =-2878 kJ;(CH3)2CHCH3(g)+6.5O2(g)
4CO2(g)+5H2O(l);DH =-2878 kJ;(CH3)2CHCH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l);DH =-2869 kJ,下列说法正确的是 ( )
4CO2(g)+5H2O(l);DH =-2869 kJ,下列说法正确的是 ( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程[来源:Zxxk.Com]
D.异丁烷分子中的碳氢键比正丁烷的多
查看习题详情和答案>>(1)组成A分子的原子的核外电子排布式是__________ ;
(2)B和C的分子式分别是_______ 和________ ;C分子的立体结构呈_______ 型,该分子属于______ 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是________ ,该反应的化学方程式为 ______ ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
查看习题详情和答案>>