网址:http://m.1010jiajiao.com/timu_id_3971882[举报]

(1)Ⅰ、Ⅲ中发生反应的还原剂分别是
(2)Ⅱ中反应的离子方程式是
(3)A的化学式是
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是
自来水厂用氯气给水消毒,对其消毒原理描述正确的是
A.利用氯气的毒性 B.利用氯气与水反应生成的HClO具有强氧化性
C.利用 氯气的漂白性 D.利用氯气与水反应生成的HCl具有强酸性
查看习题详情和答案>>
Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1) CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。
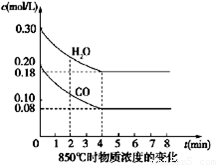
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
A.混合气体的压强
B.混合气体的密度
C.CO的物质的量浓度
D.密闭容器中放出热量
E.ν(CO)与ν(CO2)的比值
Ⅱ.(6分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
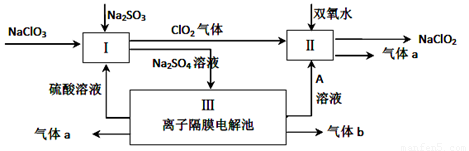
(3)配平Ⅰ中反应方程式 ClO3-+ H++ SO32-== ClO2↑+ SO42-+
(4)A的化学式是 ,。生成气体a的电极反应式 。
查看习题详情和答案>>
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度? ??????? b.氨水的电离程度
c.水的离子积常数????????? d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量??????????????? (填“相同”或“不相同”),其原因是??????????????????????????????????? 。
查看习题详情和答案>>